
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамическое равновесие в однокомпонентных системах
|
|
Уравнение Клапейрона – Клаузиуса.
Процессы, заключающиеся в превращении одной фазы вещества в другую того же вещества, протекающие без химических реакций, называются фазовыми превращениями (плавление, возгонка, испарение, полиморфные превращения).
Когда система, состоящая из нескольких фаз, достигает равновесия, то переход молекул из одной фазы в другую не прекращается. Например, в равновесной системе вода – пар молекулы все время переходят из жидкости в пар и обратно. Для равновесия характерно равенство скоростей испарения и конденсации. Равновесие таким образом поддерживается двумя противоположными процессами идущими с одинаковыми скоростями.
Фазовые равновесия разумеется могут устанавливаться и в других системах, например, в системах жидкость - твердое тело, или твердое тело – газ и др.
Состояние равновесия при постоянном Р и Т термодинамически характеризуется равенством энергией Гиббса одной и другой фазы. Например, GII = GI, т.е. изобарно – изотермические потенциалы единицы массы чистого вещества в двух фазах находящихся в равновесии, при равенстве молекулярных весов равны между собой.
При изменении энергии Гиббса одной фазы для сохранения равновесия в системе меняется энергия Гиббса другой фазы на ту же величину, т.е.
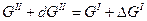 или
или 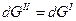
Изменение изобарно – изотермического потенциала DG может происходить только за счет изменения Р и Т, т.к. G = f (P,T).
Эта зависимость выражается в общем виде уравнением
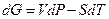
Следовательно для двух смежных фаз, находящихся в равновесии запишем
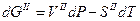
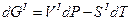
т.к. 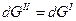 (условие равновесия),
(условие равновесия),
то 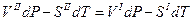
разделим переменные
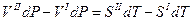
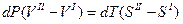
Отсюда 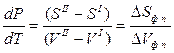
где SI и SII – энтропия 1 моля вещества в первой и во второй фазах;
VI и VII – объем 1 моля вещества в первой и во второй фазах;
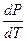 – температурный коэффициент изменения давления насыщенного пара;
– температурный коэффициент изменения давления насыщенного пара;
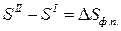 - энтропия фазового перехода,
- энтропия фазового перехода,
но 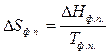 ,
,
где DНф.п. – энтальпия фазового перехода;
Тф.п. – температура фазового перехода.
Тогда уравнение примет вид
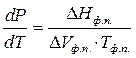 (1)
(1)
Эта зависимость была найдена Клапейроном еще до открытия I- го закона термодинамики, а затем выведена Клаузиусом. Уравнение (1) называют уравнением Клапейрона – Клаузиуса в дифференциальной форме. Оно является общим термодинамическим уравнением, применимым ко всем фазовым переходам чистых веществ (однокомпонентных систем), т.е. к процессам плавления (равновесие твердое тело - жидкость), испарения (равновесие жидкость - пар), сублимации (равновесие твердое тело - пар), полиморфного превращения (равновесие их форм), а также и обратным им процессам.
Уравнение Клапейрона – Клаузиуса можно применить к любому количеству вещества, отнеся экстенсивные величины (DН и DV) к одинаковому его количеству. Обычно эти величины относят или к молю или к грамму.
Для того, чтобы воспользоваться им для нахождения одной из зависимостей, надо знать три остальные. Например, чтобы найти зависимость давления насыщенного пара от температуры, надо знать зависимость теплоты фазового перехода (DНф.п.) от температуры и зависимость мольных объемов равновесных фаз (VI – VII) от температуры.
Рассмотрим применимость уравнения Клапейрона – Клаузиуса к фазовым переходам (плавление, испарение, сублимация), представляющим наиболее общий интерес.
Date: 2015-05-09; view: 1463; Нарушение авторских прав