
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Третий закон термодинамики
|
|
Анализируя изменения тепловых эффектов и изотермических потенциалов в области низких температур, Нернст в 1906 году высказал предположение, что при приближении к абсолютному нулю значения тепловых эффектов и изотермического потенциала сближаются, и кривые DH = f(T) и DG = f(T) при Т = 0 касаются друг друга и имеют общую касательную (рис.3). Постулат Нернста (тепловая теорема Нернста) справедлив лишь для систем, состоящих из кристаллических веществ.
В математической форме это утверждение выражается так: вблизи абсолютного нуля в реакциях, протекающих в конденсированных системах при Т = 0,
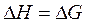 (68)
(68)
и 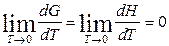 . (69)
. (69)
Уравнения (69) и (70) являются математическим выражением третьего закона термодинамики.
В соответствии с уравнением (60) 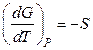 из уравнения Нернста следует, что вблизи абсолютного нуля реакции в конденсированных системах не сопровождаются изменением энтропии, т.е. для них DS = 0.
из уравнения Нернста следует, что вблизи абсолютного нуля реакции в конденсированных системах не сопровождаются изменением энтропии, т.е. для них DS = 0.
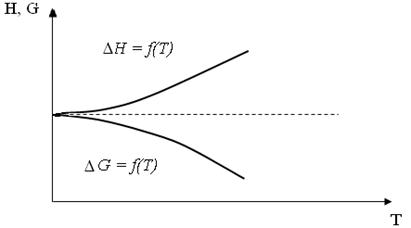
Рис. 3. Относительное положение
кривых DH=f(T) и DG=f(T ) в области
низких температур
Планк в 1912 году предположил, что энтропия правильно сформированного кристалла любого чистого вещества при абсолютном нуле равна нулю (постулат Планка).
Правильно сформированный кристалл - это кристалл с идеальной кристаллической решеткой. Математическое выражение постулата Планка:
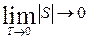 .
.
Такая зависимость отсутствует в твердых растворах и стеклообразных веществах.
И постулат Планка, и теорема Нернста – оба этих утверждения и являются третьим законом термодинамики, который получил широкое применение для определения абсолютных значений энтропий чистых веществ:
 . (70)
. (70)
Из приведенного уравнения (71) следует, что в области температур, близких к нулю, теплоемкость веществ тоже стремится к нулю:
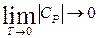 .
.
Это утверждение основывается на результатах многочисленных измерений теплоемкостей различных веществ при низких температурах.
При дальнейшем развитии термодинамики выяснился условный характер постулата Планка. Было найдено, что при абсолютном нуле некоторые составляющие энтропии, связанные со спинами ядер и изотопным эффектом, не становятся равными нулю. При обычных химических реакциях эти составляющие не меняются, поэтому их практически можно не учитывать. Для таких реакций выводы постулата Планка не нуждаются в уточнении. Однако сам постулат приобретает характер условного допущения.
Варианты заданий для расчетных работ
Определить DH, DU, DS, DF, DG реакций при постоянном давлении
Р = 1,013 105 Па и заданной температуре.
| n/n | Уравнение реакции | T, K |
| Fe2O3(т) + 3CO(г) = 2Fe(т) + 3CO2(г) | ||
| CaO(т) + CO2(г) = CaCO3(т) | ||
| Fe2O3(т) + 3C(т) = 2Fe(т) + 3CO(г) | ||
| Al2O3(т) + 3SO3(г) = Al2(SO4)3(т) | ||
| 2Fe2O3(т) + 3C(т) = 4Fe(т) + 3CO(г) | ||
| Na2CO3(т) + H2SO4(ж) = Na2SO4(т) + H2O(ж) + CO2(г) | ||
| SO3(г) + H2O(ж) = H2SO4(ж) | ||
| Na2CO3(т) + Ca(OH)2(т) = CaCO3(т) +2NaOH(т) | ||
| CaCO3(т) = CaO(т) + CO2(г) | ||
| 2K + H2SO4(ж) = K2SO4(т) + H2(г) | ||
| Ba(OH)2(т) + 2HNO3(г) = Ba(NO3)2(т) + H2O(ж) | ||
| 2FeS(т) + 3,5O2(г)= Fe2O3(т) + 2SO2(г) | ||
| 4HCl(г) + O2(г) = 2H2O(ж) + 2Cl2(г) | ||
| NH4Cl(т) = NH3(г) + HCl(г) | ||
| 2N2(г) + 6H2O(г) = 4NH3(г)+ 3O2(г) | ||
| 2H2(г) + CO(г) = CH4O(г) (метанол) | ||
| 0,5S2(г) + 2H2O(ж) = SO2(г) + 2H2(г) | ||
| 0,5S2(г) + 2CO2(г) = SO2(г) + 2CO(г) | ||
| SO2(г) + Cl2(г) = SO2Cl2(г) | ||
| 4NO(г) + 6H2O(г) = 4NH3(г)+ 5O2(г) | ||
| 2H3PO4(ж) + Ca(OH)2(т) = Ca(H2PO4)2 + 2H2O(ж) | ||
| 2KOH(т) + H2SO4(ж) = K2SO4(т) + H2O(г) | ||
| SO2(г) + 2CO(г) = S(ромб) + 2CO2(г) | ||
| K2CO3(т) + 2HNO3(ж) = 2KNO3(т) + H2O(ж) + CO2(г) | ||
| NaI(т) + HCl(г) = NaCl(т) + HI(г) | ||
| Ca(OH)2(т) + 2HCl(г) = CaCl2(т) + 2H2O(ж) | ||
| Ba(OH)2(т) + H2SO4(ж) = BaSO4(т) + 2H2O(ж) | ||
| BeO(т) + H2SO4(ж) = BeSO4(т) + H2O(ж) | ||
| Al2O3(т) + 6HCl(г) = 2AlCl3(т) + 3H2O(г) | ||
| CuO(т) + H2S(г) = CuS(т) +H2O(г) | ||
| CuO(т) + 2HCl(г) = CuCl2(т) + H2O(ж) | ||
| 2CO(г) + 3H2(г) = H2O(ж) + C2H4O(г) (ацетальдегид) | ||
| Ag2O(т) + 2HNO3(ж) = 2AgNO3(т) + 2H2O(ж) | ||
| CO2(г) + 2NH3(г) = H2O(ж) + CH4N2O(т) (карбамид) | ||
| NaNO3(т) + KCl(т) = NaCl(т) + KNO3(т) | ||
| 4NH3(г)+ 4NO2(г) + 2H2O(ж) + O2(г) = 4NH4NO3(т) | ||
| (NH4)2SO4(т) + Ba(NO3)2 = BaSO4(т) + 2NH4NO3(т) | ||
| (NH4)2SO4(т) + CaCl2(т) = CaSO4(т) + 2NH4Cl(т) | ||
| C2H2(г) + H2O(ж) = C2H4O(г) (ацетальдегид) | ||
| CH4(г) + HNO3(ж) = H2O(ж) + CH3NO2(г) (нитрометан) | ||
| 8Al(т) + 3Fe3O4(т) = 9Fe(т) + 4Al2O3(т) | ||
| 2NH4NO3(т) = 4H2O(ж) + O2(г) + 2N2(г) | ||
| C2H2(г) + 2H2O(ж) = CH3COOH(ж) + H2(г) | ||
| CH4(г) + 2H2S(г) = CS2(г) + 4H2(г) | ||
| H2S(г) + CO2(г) = H2O(г)+ COS(г) | ||
| 2NaHCO3(т) = Na2CO3(т) + H2O(г)+ CO2(г) | ||
| Zn(OH)2(т) + CO2(г) = ZnCO3(т) + H2O(ж) | ||
| ZnS(т) + H2SO4(ж) = ZnSO4(т) + H2S(г) | ||
| 2AgNO3(т) = 2Ag(т) + O2(г) +2NO2(г) | ||
| 2KMnO4(т) + 3H2O2(г) = 2MnO2(т) + 2KOH(т) + 3O2(г) + 2H2O(ж) | ||
| KClO3(т) + H2O2(г) = KCl(т) + 2O2(г) + H2O(ж) | ||
| 3Cl2(г) + 6KOH(т) = KClO3(т) + 3H2O(ж) + 5KCl(т) | ||
| 4Cl2(г) + H2S(г) + 4H2O(ж) = 8HCl(г) + H2SO4(ж) | ||
| 2KOH(т) + MnO(т) + Cl2(г) = MnO2 + 2KCl(т) + H2O(ж) | ||
| P(т) + 5HNO3(ж) = H3PO4(ж) + 5NO2(г) + H2O(ж) | ||
| Cu(т) + 2H2SO4(ж) = CuSO4(т) + SO2(г) + 2H2O(ж) | ||
| PbS(т) + 4H2O2(г) = PbSO4(т) + 4H2O(ж) | ||
| 8HJ(г) + H2SO4(ж) = 4J2 + H2S(г) + 4H2O(ж) | ||
| Ca(OH)2(т) + H2S(г) = CaS(т) + 2H2O(ж) | ||
| P2O5(т) + 3H2O(ж) = 2H3PO4(ж) |
Date: 2015-05-09; view: 2082; Нарушение авторских прав