
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Расчетные формулы энергии Гиббса и энергии Гельмгольца
|
|
· Стандартная энергия Гиббса реакции равна сумме стандартных энергий Гиббса продуктов реакций за вычетом суммы стандартных энергий Гиббса исходных веществ с учетом стехиометрических коэффициентов уравнения реакции.
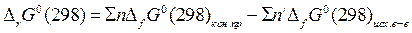 (63)
(63)
где 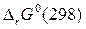 - стандартная энергия Гиббса реакции,
- стандартная энергия Гиббса реакции,
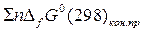 - сумма стандартных энергий Гиббса продуктов реакции,
- сумма стандартных энергий Гиббса продуктов реакции,
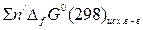 - сумма стандартных энергий Гиббса исходных веществ,
- сумма стандартных энергий Гиббса исходных веществ,
n, n/ - стехиометрические коэффициенты исходных веществ и конечных продуктов в уравнении реакции.
Стандартные значения энергии Гиббса для 1 моля вещества при Т = 298 К приведены в справочнике /5, табл.44; 6, табл.1/.
Пример 1. Рассчитать стандартные энергии Гиббса и Гельмгольца реакции, используя значения стандартных энергий Гиббса, приведенных в справочнике /5, табл.44/:
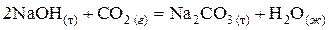 .
.
Решение:
1) Расчет энергии Гиббса.
Находим в справочнике /5, табл.44/ значения стандартных энергий Гиббса для веществ реакции:
а) продукты реакции
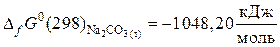 ,
,
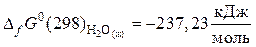 ,
,
б) исходные вещества
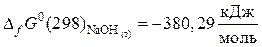 ,
,
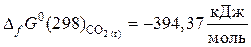 .
.
Применяя уравнение (63), получим:
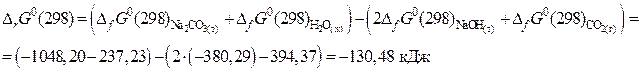
Вывод. Полученное значение энергии Гиббса (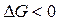 ) указывает на то, что данная реакция в закрытой системе может протекать в стандартных условиях в прямом направлении.
) указывает на то, что данная реакция в закрытой системе может протекать в стандартных условиях в прямом направлении.
2) Расчет энергии Гельмгольца.
Для расчета изохорно-изотермического потенциала рассмотрим соотношение между энергией Гиббса и энергией Гельмгольца:
 ,
, 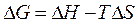 , но
, но 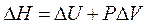 .
.
Тогда:
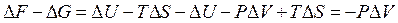 , (64)
, (64)
т.е. 
Если в реакции принимают участие только конденсированные фазы (твердые и жидкие вещества), то изменение объема DV равно нулю.
Если в реакции участвуют газообразные продукты, то изменением объема пренебрегать нельзя.
Рассмотрим простейший случай, когда газы, участвующие в реакции, подчиняются законам идеального газа. Тогда согласно уравнению Клапейрона-Менделеева можно записать PDV=DnRT.
Dn=n кон - n исх,
где n кон - число молей газообразных конечных продуктов;
nисх – число молей газообразных исходных веществ.
В нашем примере газообразный продукт один – углекислый газ, поэтому Dn = 0 - 1= - 1.
Тогда 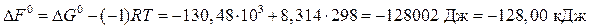
Вывод. Т.к. полученное в результате расчета значение DF <0, то в изохорно-изотермическом процессе в закрытой системе будет протекать самопроизвольный процесс.
· Для нахождения энергии Гиббса можно применять уравнение (56), которое дает возможность производить расчет как в стандартных условиях, так и при любой другой температуре.
Пример 2. Вычислить энергию Гиббса и Гельмгольца при Т 1 = 298 К и Т 2 = 473 К, при постоянном давлении 1,013×105 Па для реакции:
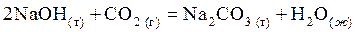 .
.
Как скажется повышение температуры на направления протекания данной реакции?
Решение. Для расчета DG реакции воспользуемся уравнением (56):
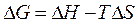 ,
,
где DH и DS - соответственно изменение энтальпии и энтропии реакции при заданной температуре:
а) Т =298 К.
Определяем изменение стандартной энтальпии реакции DrH0 (298) (расчет приведен в примере 1 раздела 1.3.3): DrH0 (298) = -170,42 кДж.
Определяем изменение стандартной энтропии реакции DrS0 (298) (расчет приведен в примере 1 раздела 1.5.4): DrS0 (298) = -133,77 Дж.
Подставим полученные данные в уравнение (56):
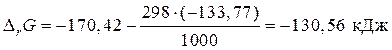 .
.
Вывод. Расчет стандартной энергии Гиббса по справочным данным, приведенный в предыдущем примере, и расчет по уравнению (56), приведенный в данном примере, практически совпадают. Относительная ошибка составляет:
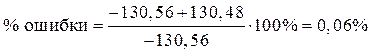 .
.
Расчет DF (298) см. в этом же разделе, пример 1.
б) Т = 473 К.
Определяем изменение энтальпии реакции DrH (473) (расчет приведен в примере 2 раздела 1.4.2):
DrH (473) = -125,79 кДж.
Определяем изменение энтропии реакции DrS (473) (расчет приведен в примере 1 раздела 1.5.4):
DrS (473) = -12,9 Дж.
Подставим полученные данные в уравнение (56):
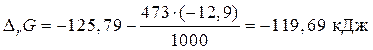
Расчет DF проводим согласно уравнению (64):
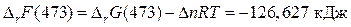 .
.
Вывод. Ответ на последний вопрос задачи определяется знаком DrS и DrH (см. табл. 1). В нашем случае 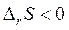 , т.е. в уравнении
, т.е. в уравнении 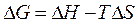 член (- TDS) для нашей реакции положителен. Следовательно, с повышением температуры Т в изобарно-изотермическом процессе значение DrG будет возрастать (т.е. становиться менее отрицательным). Это означает, что повышение температуры будет препятствовать протеканию рассматриваемой реакции в прямом направлении.
член (- TDS) для нашей реакции положителен. Следовательно, с повышением температуры Т в изобарно-изотермическом процессе значение DrG будет возрастать (т.е. становиться менее отрицательным). Это означает, что повышение температуры будет препятствовать протеканию рассматриваемой реакции в прямом направлении.
В изохорно-изотермическом процессе будут наблюдаться аналогичные тенденции для энергии Гельмгольца.
· Можно рассчитать DrG, воспользовавшись уравнением (60), если в химическом процессе давление остается неизменным. Для химической реакции это уравнение примет вид:
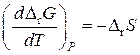 .
.
Преобразуем данное уравнение 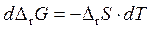 и проинтегрируем:
и проинтегрируем:
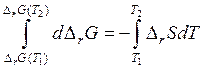 .
.
Если Т1 = 298 К, то уравнение примет вид:
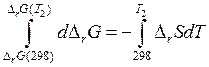 или
или 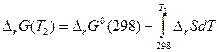 (65)
(65)
В зависимости от степени точности возможны три варианта расчета энергии Гиббса по этому способу.
Первый вариант. Предположим, что энтропия реакции не зависит от температуры, т.е. DrS0 (298) = DrS (Т2), тогда:
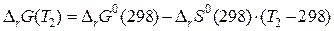 . (66)
. (66)
Полученный результат расчета дает существенную погрешность.
Пример 3. Вычислить энергию Гиббса предложенным способом для реакции:
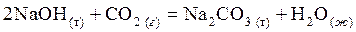 .
.
При Т 2 = 473 К, при постоянном давлении 1,013×105 Па.
Решение.
Стандартную энергию Гиббса находим по уравнению (63) (см. пример 1 в разделе 1.5.8.): DrG0 (298) = -130,48 кДж.
Определяем изменение стандартной энтропии реакции DrS0 (298) (расчет приведен в примере 1 раздела 1.5.4): DrS0 (298) = -133,77 Дж.
Подставим полученные данные в уравнение (66) и произведем расчет: 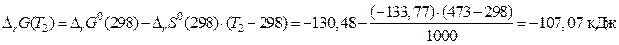 .
.
Вывод. Результат расчета отличается от результата в примере 2,б раздела 1.5.8, т.к. последний вариант является приближенным, не учитывается фазовый переход воды.
Второй вариант. Предположим, что энтропия реакции зависит от температуры
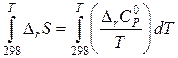 или
или 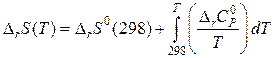 .
.
Если теплоемкость не зависит от температуры DrСР = const, то после интегрирования имеем:
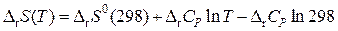 D.
D.
Подставим полученное значение D r S (Т)в (65):
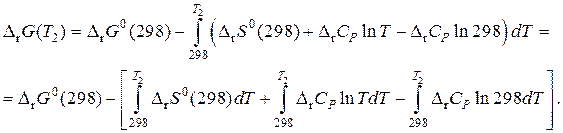
После интегрирования получим:
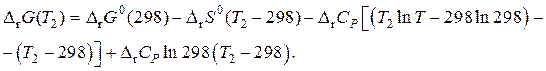 (67)
(67)
Пример 4. Рассчитать изменение энергии Гиббса при Т = 473К реакции:
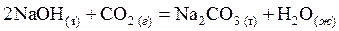 ,
,
учитывая зависимость энтропии реакции от температуры.
Решение.
Определяем D r СР реакции по первому следствию закона Гесса:
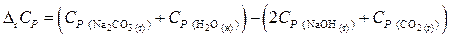
Воспользуемся значениями стандартных изобарных теплоемкостей для индивидуальных веществ, приведенных в справочнике /5, табл. 44/:
а) продукты реакции:
 ,
,
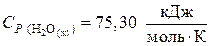 ;
;
б) исходные вещества:
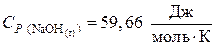 ,
,
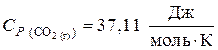 .
.
Тогда 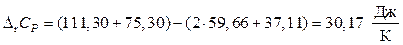 .
.
Расчет стандартной энергии Гиббса для данной реакции приведен в примере 1 раздела 1.5.8. DrG0 (298) = -130,48 кДж.
Расчет стандартной энтропии для данной реакции приведен в примере 1 раздела 1.5.4. DrS0 (298) = -133,77 Дж.
Подставляя полученные значения в (67), получим:
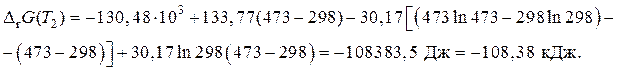
Вывод: данный расчет также является приближенным, т.е. он не учитывает зависимость теплоемкости от температуры, но более точным, чем первый способ, рассмотренный выше.
Пример, рассматриваемый нами, является более сложным, т.к. в предложенном интервале температур у одного из веществ, а именно у воды, существует фазовый переход, что необходимо учитывать. Это усложняет расчет и делает его громоздким.
В таких случаях вычислить энергию Гиббса можно, воспользовавшись формулой (56). Расчет этот приведен в примере 2 раздела 1.5.8.
На практике часто для расчета энергии Гиббса используют метод Темкина - Шварцмана (1946 г.), позволяющий стандартную энергию Гиббса при 298 К пересчитать для любой температуры /1, 4, 7, 8/.
Пример 5. Вычислить изменение энергии Гиббса при изотермическом сжатии 0,005 м3 кислорода от Р1 =0,1013×105 Па до Р2 =1,013×105 Па (Т = 00С), считая кислород идеальным газом.
Решение. Из уравнение Менделеева-Клапейрона находим число молей кислорода, участвующих в реакции:
PV=nRT,
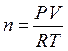 :
:
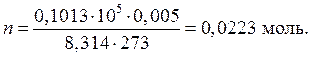
Для определения DG воспользуемся формулой (58):
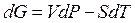 .
.
Т.к. процесс протекает при Т= const, то второе слагаемое будет равно нулю. Расчет проводим по формуле dG = VdP.
Из уравнения Менделеева-Клапейрона выразим V:
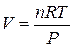 .
.
Подставляем:
 .
.
Интегрируем и подставляем данные задачи:
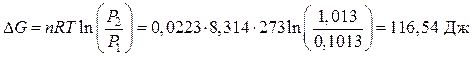
Вывод. При изотермическом сжатии кислорода процесс не может протекать самопроизвольно.
Пример 6. Теплота плавления льда при 00С равна 335 Дж/г. Удельная теплоемкость воды равна 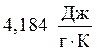 . Удельная теплоемкость льда равна
. Удельная теплоемкость льда равна 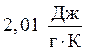 . Найти DG, DH, DS для процесса превращения 1 моль переохлажденной воды при – 50С в лед.
. Найти DG, DH, DS для процесса превращения 1 моль переохлажденной воды при – 50С в лед.
Решение. Переохлажденная жидкость не находится в состоянии равновесия с твердой фазой. Рассматриваемый процесс не является статическим, поэтому вычислить энтальпию и энтропию по теплоте кристаллизации для переохлажденной жидкости нельзя.
Для вычисления данных функций мысленно заменим нестатический процесс тремя квазистатическими, в результате которых система придет из начального состояния в конечное.
1-й процесс. Нагревание обратимым путем 1 моль воды до температуры замерзания. При этом изменение энтальпии и энтропии согласно уравнениям (26) и (36):
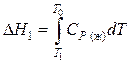 ,
, 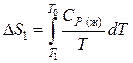
где СР – молярная теплоемкость воды,
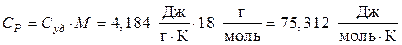 .
.
Подставляя в формулы данные задачи, получим:
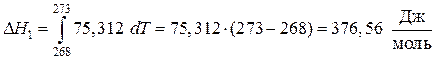 ,
,
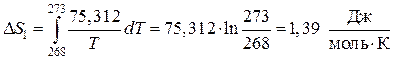
2-й процесс. Кристаллизация воды при 00С (273 К). В условиях задачи дана удельная теплота плавления (DН плавл), т.е. теплота фазового перехода 1 г воды из твердого состояния в жидкое.
Т.к. 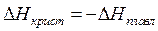 ,
,
то 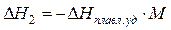 ,
,
где DН2 – теплота кристаллизации 1 моля воды,
DН плавл. уд – удельная теплота плавления, приведенная в задаче,
М – молярная масса воды.
Тогда 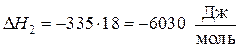 .
.
Энтропия фазового перехода рассчитывается по формуле (47):
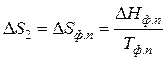 .
.
Подставим данные и получим:
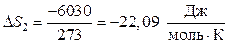
3-й процесс. Обратимое охлаждение льда от 273 до 268 К. Расчет энтальпии и энтропии проводим аналогично первому процессу.
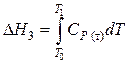 ,
, 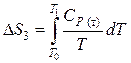 ,
,
где СР – молярная теплоемкость льда,
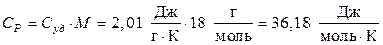 .
.
Подставляя данные, получим:
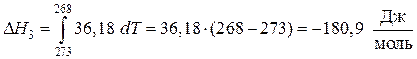 ,
,
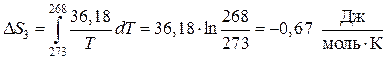
Общее изменение энтальпии и энтропии в изобарном процессе
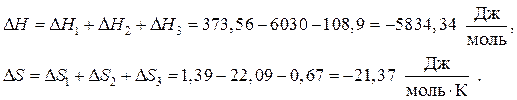
Изменение энергии Гиббса в рассматриваемом процессе рассчитывается по формуле (56).
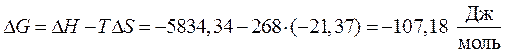 .
.
Вывод. По результатам расчета видно, что при превращении 1 моль переохлажденной воды в лед энтальпия и энтропия в системе убывает. Это значит, что самопроизвольный процесс в таком случае возможен только при низких температурах, когда энергия Гиббса DG приобретает отрицательные значения (см. табл.2), что мы и наблюдаем в нашем примере.
Date: 2015-05-09; view: 19503; Нарушение авторских прав