
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Изобарно-изотермический потенциал (энергия Гиббса)
|
|
Рассмотрим процессы, протекающие в системе при постоянном давлении или температуре. Из уравнения (34) получим выражение для полезной работы:
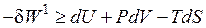 ,
,
но 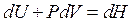 , тогда:
, тогда:
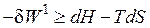 или
или 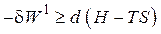 .
.
H, T и S являются функциями состояния, следовательно, и выражение в скобках тоже будет функцией состояния. Ее и назвали изобарно-изотермическим потенциалом, или энергией Гиббса и обозначили G.
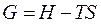 . (55)
. (55)
Изменения состояния системы в изобарно-изотермическом процессе выражаются через
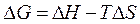 . (56)
. (56)
Это значит в системе, находящейся при постоянном давлении или температуре, изобарный потенциал является мерой энергии, способной полностью переходить в полезную работу, поэтому часто его называют свободной энергией Гиббса. Другая же часть полной энергии (TDS) - связанная энергия - не дает работы, а переходит только в теплоту, которая бесполезно рассеивается в окружающую среду.
Так как большинство химических реакций сопровождаются только работой расширения, то 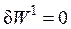 , тогда:
, тогда:
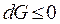 (57)
(57)
Из полученного неравенства видно, какой процесс протекает в системе:
· если 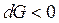 (энергия Гиббса убывает, DG имеет отрицательное значение), то в системе протекает самопроизвольный процесс;
(энергия Гиббса убывает, DG имеет отрицательное значение), то в системе протекает самопроизвольный процесс;
· если 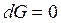 (энергия Гиббса не меняется), то система находится в равновесии;
(энергия Гиббса не меняется), то система находится в равновесии;
· если  (энергия Гиббса возрастает, DG имеет положительное значение), то в системе протекает несамопроизвольный процесс.
(энергия Гиббса возрастает, DG имеет положительное значение), то в системе протекает несамопроизвольный процесс.
Как показывает практика, для химических реакций возможны следующие утверждения:
· если 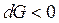 , реакция возможна и протекает самопроизвольно не только в стандартных, но и при любых условиях,
, реакция возможна и протекает самопроизвольно не только в стандартных, но и при любых условиях,
· если 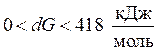 возможность осуществить реакцию сомнительна, необходимо провести расчет с целью определения условий, при которых
возможность осуществить реакцию сомнительна, необходимо провести расчет с целью определения условий, при которых 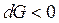 ;
;
· если 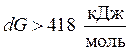 , реакция неосуществима в обычных условиях, возможно она будет протекать при необычных давлении и температуре /7/.
, реакция неосуществима в обычных условиях, возможно она будет протекать при необычных давлении и температуре /7/.
Таким образом, изобарно-изотермический потенциал является критерием, определяющим направленность термодинамического процесса при независимых переменных - температуре и давлении.
Продифференцируем уравнение (55), считая все параметры состояния (P, V, T) переменными:
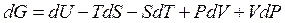 .
.
Если учесть, что 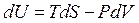 , то, подставляя dU и приводя подобные члены, получим:
, то, подставляя dU и приводя подобные члены, получим:
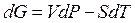 . (58)
. (58)
Из полученного уравнения находим:
а) при постоянной температуре:
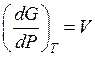 . (59)
. (59)
Вывод: Объем системы является мерой возрастания энергии Гиббса с увеличением давления при постоянной температуре;
б) при постоянном давлении
 . (60)
. (60)
Вывод: Энтропия является мерой убыли термодинамического потенциала системы с увеличением температуры при постоянном давлении.
Date: 2015-05-09; view: 1752; Нарушение авторских прав