
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Начала термодинамики
|
|
ТЕРМОДИНАМИКА И МОЛЕКУЛЯРНАЯ ФИЗИКА
Раздел 1. Термодинамика
Термодинамика - феноменологическая теория. Она изучает явления и свойства
макроскопических тел, связанные с превращением энергии и не рассматривает их внутреннее строение. Термодинамика изучает превращение энергии не только в тепловых процессах, но и в электрических, химических, магнитных и других.
Термодинамика как физическая теория построена по методу принципов. В её основе лежат начала.
Основные понятия и законы термодинамики.
Термодинамическая система. Термодинамической системой называется тело или совокупность тел, обменивающихся энергией между собой и с внешними телами. Если обмена с внешними телами нет, то система называется изолированной. Например, можно считать изолированной системой воздух, который находится в аудитории, где закрыты все окна и двери.
Состояние термодинамической системы определяется рядом параметров, например.
температура, давление, объём, плотность, вязкость и т.д. Состояние системы может быть равновесным и неравновесным. Состояние термодинамической системы называется равновесным, если при отсутствии внешних воздействий с течением времени все параметры остаются неизменными. Изолированная термодинамическая система с течением времени всегда приходит в равновесное состояние.
Термодинамическим процессом называется переход термодинамической системы из равновесного состояния в другое равновесное состояние под влиянием внешнего воздействия.
Уравнения, устанавливающие взаимосвязь термодинамических параметров системы, могут быть записаны только для состояния термодинамического равновесия. Графически можно изобразить только равновесное (квазистатическое) состояние и равновесный (квазистатический) процесс.
Идеальный газ -система, характеризуемая внешним параметром (объём) и внутренними параметрами (температура и давление) или идеальный газ - газ, у которого при изотермическом процессе (постоянная температура) давление обратно пропорционально объёму при постоянной массе.
Уравнение состояния идеального газа (уравнение Клапейрона - Менделеева):
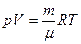 ,
,
где m - масса газа. p, V, T - параметры равновесного состояния, R - универсальная газовая постоянная. R = 8,31 Дж/(моль · К); 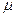 - молярная масса этого газа.
- молярная масса этого газа.
Частные случаи уравнения представлены в табл. 1 изопроцессов.
Таблица 1
| Название процесса | Постоянная величина | Уравнение |
| Изотермический | Т - const | pV = const (закон Бойля – Мариотта) |
| Изохорный | V - const |  = const
(закон Шарля) = const
(закон Шарля)
|
| Изобарный | р - const | 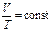 (закон Гей-Люссака)
(закон Гей-Люссака)
|
Температура - внутренний параметр состояния термодинамической системы. Характеризует состояние теплового равновесия системы.
Удельная теплоёмкость вещества - величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1К: с = 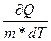 .
.
Молярная теплоёмкость - величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К: 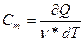 , где
, где  - количество вещества, выражающее число молей.
- количество вещества, выражающее число молей.
Удельная теплоёмкость связана с молярной соотношением: Cm = c*µ.
Уравнение Майера: Cp = Cv + R,
где Cp - молярная теплоёмкость газа при постоянном давлении, Cv - молярная теплоёмкость газа при постоянном объёме.
Число степеней свободы (i) - число независимых координат полностью определяющих положение системы в пространстве. Для одноатомного идеального газа положение молекулы однозначно определяется 3 -мя координатами и число степеней свободы рано 3. Для двухатомного газа число степеней свободы равно 5.
Cv = i*R/2.
Внутренняя энергия - функция состояния системы, однозначно определяемая параметрами состояния. Внутренняя энергия всегда отлична от нуля, даже при температуре абсолютного нуля. Внутренняя энергия пропорциональна температуре
Закон Больцмана о равномерном распределении энергии по степеням свободы: для статистической системы, находящейся в состоянии термодинамического равновесия. на каждую поступательную и вращательную степень свободы приходится в среднем кинетическая энергия равная kT/2, а на каждую колебательную степень свободы - в среднем энергия, равная kT.
Внутренняя энергия для случая одноатомного идеального газа может быть вычислена по формуле: 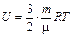 .
.
Формулы для вычисления характеристик изолированной термодинамической системы в равновесном состоянии для различных частных случаев представлены в табл. 2.
Таблица 2
| Параметр | Изохорный процесс процесс | Изотермический процесс | Изобарный процесс | Адиабатный процесс |
| р | 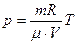
| 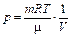
| p - const | 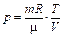
|
| V | V - const | 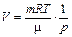
| 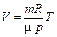
| 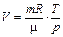
|
| Т | 
| Т = const | 
| 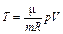
|
| Q | 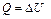
| Q = А’ | 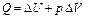
| Q = 0 |
| А ’ | А’ = 0 | А’ = 0 | A’ = p Δ V | А ’ = - Δ U |
Начала термодинамики
Первое начало термодинамики -количество теплоты, сообщаемое системе, расходуется на изменение её внутренней энергии и на совершение ею работы против внешних сил Q = ∆U + A.
Круговым процессом (циклом) называется процесс, при котором система пройдя через ряд состояний возвращается в исходное.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. Если, процесс идёт сначала в прямом, а потом в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений.
В ходе нескольких процессов газ может вернуться в первоначальное состояние, т.е. будет совершен цикл. Если процессы равновесные, то они могут быть изображены графически. Пусть цикл состоит из двух изохор и двух изобар. Имеет ли смысл последовательность процессов? Сравним 2 случая (рис. 1):
 |
а) р б) р
|
Стрелочки на рис. 2 показывают направление протекания каждого процесса. При изохорных процессах работа не совершается. При изобарных процессах работа равна площади прямоугольника, ограниченного графиком процесса и изохорами. Анализировать графики помогает табл. 3.
Таблица 3
| График (рис. 2, а) | График (рис. 2, б) | Участок графика |
| Изохора: Т увеличивается (Δ Т > 0)). Подводится количество теплоты (Q > 0): Δ U = Q, A = 0 Изобара: Δ Т > 0, Q > 0, А ' > 0 газ совершает работу Изохора: Δ Т < 0, Q < 0 (выделяется) Δ U = Q, Δ U < 0, А = 0 Изобара: Δ Т < 0, Q < 0, А > 0 над газом совершается работа | Изобара: Δ Т > 0, Q > 0, А ' > 0 газ совершает работу Изохора: Δ Т > 0, Q > 0, Δ U = Q, А = 0 Изобара: Δ Т < 0, Q < 0, А > 0 над газом совершается работа Изохора: Δ Т < 0, Q < 0, Δ U = Q, А = 0 | 1-2 2-3 3-4 4-1 |
| По графику | A | < | A ’| | По графику | A | > | A ’| | |
| За цикл газ совершает работу A ’ = (p 2 - p 1) (V 2 - V 1) | За цикл над газом совершается работа A = (p 2 - p 1) (V 2 - V 1) |
Приведённым количеством теплоты называется отношение количества теплоты Q, полученной телом в изотермическом процессе к температуре T теплоотдающего тела.
Энтропией S называется функция состояние, дифференциалом которой является отношение σQ / T.
Для обратимых процессов ∆S = 0
Для необратимых процессов ∆S > 0
Энтропия замкнутой системы может либо возрастать, либо оставаться постоянной.
Неравенство Клаузиуса ∆ S ≥ 0.
Термодинамическая вероятность состояния системы W - число способов, которыми может быть реализовано данное состояние макроскопической системы.
S = k ln W,
где k – постоянная Больцмана.
Второе начало термодинамики - любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Третье начало термодинамики (теорема Нернста - Планка) – энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина.
limS = 0
T→ 0
Date: 2015-05-09; view: 1344; Нарушение авторских прав