
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Способы задания состава смеси
|
|
В технике часто имеют дело с газовыми смесями, близкими по свойствам с идеальными газами. Такие газы представляют механическую смесь отдельных газов. Примером газовой смеси может служить воздух, который состоит из кислорода, углекислого газа, водяных паров и одноатомных газов. Поэтому, для решения практических задач необходимо уметь определять основные параметры газовой смеси: газовую постоянную, среднюю молекулярную массу, парциальные давления и др.
Под газовой смесью понимается система, состоящая из нескольких газов, не вступающих между собой в химические реакции. Каждый газ в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси. Молекулы газа создают давление на стенки сосуда, которое называется парциальным (частичным). При этом считается, что каждый газ, входящий в газовую смесь, подчиняется уравнению состояния Клапейрона, т.е. он является идеальным газом. Газовая смесь идеальных газов подчиняется закону Дальтона - общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих газовую смесь:
p = p1 + p2 +…+ pn = 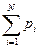 , (2.1)
, (2.1)
где р1, р2,…, рn - парциальные давления.
Парциальное давление - это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Параметры газовой смеси могут быть вычислены по уравнению Клапейрона
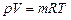 ,
,
где все величины, входящие в уравнение, относятся к газовой смеси.
Задачей расчета является определение при заданном составе смеси средней молекулярной массы, или газовой постоянной смеси, после чего получение всех остальных параметров можно произвести по уравнению состояния для смеси.
Газовая смесь может быть задана массовыми, объемными и мольными долями.
Массовой долей (массовой концентрацией) называется отношение массы каждого газа к общей массе смеси.
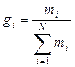 , доли ед.;
, доли ед.; 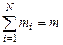 кг;
кг; 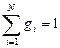 ,
,
где gi - массовая доля i -го газа; mi - масса i -го газа, кг; m - масса газовой смеси, кг; i = 1, 2, …, N - число компонентов составляющих газовую смесь.
Объемной долей (объемной концентрацией) называется от-
ношение парциального (приведенного) объема каждого газа к общему объему смеси газов:
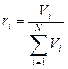 доли ед.;
доли ед.; 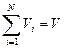 м3;
м3; 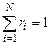 ,
,
где ri - объемная доля концентрация i -го газа; Vi - парциальный объем i -го газа, м3; V - объем, занимаемый газовой смесью, м3.
Парциальным объемом называется объем, который занимал бы этот газ, если бы его давление и температура равнялись давлению и температуре смеси газов.
Парциальный объем каждого газа можно определить по закону Бойля-Мариотта. При постоянной температуре будем иметь:
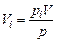 м3.
м3.
Задание смеси мольными долями равнозначно заданию ее объемными долями. Мольной долей называется отношение числа киломолей каждого газа Мi к числу киломолей газовой смеси М. Так как объемы 1 кмоля различных газов при одинаковых давлениях и температуре равны, то
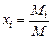 ,
,
где xi - мольная доля (мольная концентрация) i-го газа.
Мольная масса газа есть масса, численно равна молекулярной массе, отнесенной к 1 киломолю газа
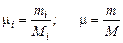 [кг/кмоль].
[кг/кмоль].
Мольные доли будут равны
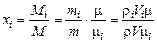 доли ед.
доли ед.
Для плотности газа можно написать
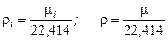 [ кг / м 3].
[ кг / м 3]. 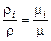 .
.
Подставив соотношение плотностей в выражение для мольной концентрации, будем иметь
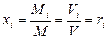 .
.
Date: 2015-05-09; view: 4528; Нарушение авторских прав