
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные параметры состояния
|
|
Установление границ между системой и ее внешней средой является лишь необходимым элементом описания термодинамической системы. Кроме того систем описывается рядом переменных, т.е. физических величин, характеризующих ее свойства. Поскольку в классической термодинамике ограничиваются лишь системами макроскопических размеров, то свойства системы определяются здесь малым числом переменных. Например, если системой является определенное количество газа в цилиндре или баллоне, то для описания этой системы задаются не координаты всех молекул газа и их скорости
или импульсы, а несколько макроскопических переменных - объем 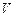 , давление
, давление 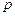 и масса
и масса 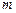 . Если переменные принимают устойчивые значения, то говорят, что система находится в определенном состоянии. Таким образом, понятие «состояние» характеризуется с помощью переменных системы; они определяют состояние, принимая устойчивые значения. Поэтому переменные системы называются ее параметрами состояния.
. Если переменные принимают устойчивые значения, то говорят, что система находится в определенном состоянии. Таким образом, понятие «состояние» характеризуется с помощью переменных системы; они определяют состояние, принимая устойчивые значения. Поэтому переменные системы называются ее параметрами состояния.
Основными термодинамическими параметрами состояния являются давление, температура и удельный (молярный) объем.
Давлением называется физическая величина  p, равная пределу отношения численного значения нормальной силы
p, равная пределу отношения численного значения нормальной силы 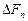 , действующей на участок поверхности тела площадью DS, к величине
, действующей на участок поверхности тела площадью DS, к величине 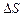 при
при 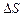 , стремящейся к нулю:
, стремящейся к нулю:
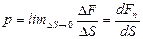 . (1.1)
. (1.1)
Давление есть результат воздействия молекул газа на стенки сосуда, в котором он находится.
За единицу измерения давления в системе СИ принимается 1 Па, численно равны силе в 1 Н, равномерно распределенной на площади в 1 м2, т. е. 1Па = 1 Н/м2, где 1Н = 1 кг×м/с2. Единицами давления служат кратные и дольные от паскаля:
1 кПа (килопаскаль) = 103 Па;
1 МПа (мегапаскаль) = 106 Па;
1 мПа (миллипаскаль) = 10-3 Па и др.
Соотношения между ранее применявшимися, а теперь подлежащими замене, единицами давления и единицами СИ следующие:
1 кгс/см2 = 10 м вод. ст.= 98066 Па;
1 атм = 101,325 кПа = 760 мм рт.ст. = 1 кгс/см2.
1 бар = 0,1 МПа = 1 атм.
Существующие приборы для измерения давления (манометры и вакуумметры) определяют разность давления газа в сосуде и внешнего атмосферного давления. Эта разность положительна, если давление в сосуде больше, чем атмосферное. Положительная разность давлений, которая измеряется манометром, называется избыточным или рабочим давлением.
Действительное давление газа в сосуде называется абсолютным. Это давление является термодинамическим параметром и должно входить в расчетные формулы.
Если в сосуде 1 (рис. 1.3-а) абсолютное давление 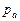 больше атмосферного (барометрического)
больше атмосферного (барометрического) 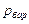 , то пружинный манометр 2 покажет избыточное (рабочее) давление, которое равно
, то пружинный манометр 2 покажет избыточное (рабочее) давление, которое равно
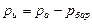 или
или 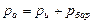 .
.
При использовании жидкостного манометра 3 избыточное давление выражается высотой столба жидкости, причем
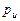 = h (мм вод. ст.) / 104 = h (мм рт. ст.) / 735,6.
= h (мм вод. ст.) / 104 = h (мм рт. ст.) / 735,6.
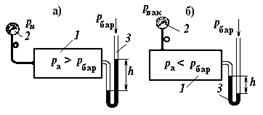
Рис.1.3. Способы измерения давления:
1 - сосуд с газом, 2 - пружинный манометр (вакуумметр),
3 - жидкостной манометр: а) - избыточное давление,
б) - недостаточное давление.
Если абсолютное давление в сосуде меньше атмосферного, то в нем будет существовать разрежение (вакуум).
На рис. 1.3-б показано измерение разрежения в сосуде 1 пружинным 2 или жидкостным 3 вакуумметром, в этом случае
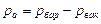 или
или 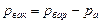 .
.
Удельным объемом v называется величина обратная плотности r, то есть v = 1/r. Для однородного тела удельный объем равен отношению его объема к массе, т.е. численно равен объему элемента этого тела, масса которого равна единице.
Грамм-молекулой или молем (килограмм молекулой или киломолем) называется такое количество химически однородного вещества, масса которого, выраженная в граммах (килограммах), численно равна его молекулярному весу m. Объем V m одного моля вещества называется его молярным объемом:
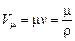 . (1.2)
. (1.2)
Грамм-атомом (килограмм атомом) называется такое количество химически простого вещества (элемента), масса которого, выраженная в граммах (килограммах), равна его атомному весу. Например, для кислорода 1 кмоль равен 32 кг, для азота - 28 кг.
Число молекул в грамм-молекуле и число атомов в грамм-атоме для всех веществ - одинаковы. Это число выражается числом Авогадро N A (N A = 6,023×1023 моль-1 = 6,023×1026 кмоль-1).
Температурой называется физическая величина, характеризующая степень нагретости тела. В состоянии термодинамического равновесия системы температуры всех тел, образующих систему, одинаковы. Измерение температуры можно производить только косвенным путем, основываясь на зависимости от температуры таких физических свойств тел, которые поддаются непосредственному измерению. Применяемые для этого тела (вещества) называются термометрическими, а устанавливаемая с их помощью шкала температуры - эмпирической.
Основной недостаток эмпирических шкал состоит в их зависимости от специфических особенностей конкретных термометрических веществ. В качестве исходных значений, служащих для построения шкалы температуры для установления начала отсчета температуры и единицы ее измерения - градуса, применяются температуры перехода химически чистых веществ из одного агрегатного состояния в другое, например, температуры плавления льда (t o) и кипения воды (t к) при нормальном атмосферном давлении, равном 760 мм рт. ст. Величины t o и t к в зависимости от типа шкалы имеют следующие значения:
а) Шкала Цельсия (стоградусная шкала): t o = 0°С, t к = 100°С;
б) Шкала Фаренгейта: t o = 32°F, t к = 212°F.
Связь между температурами, выраженными в градусах Цельсия и Фаренгейта, имеет вид:
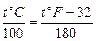 . (1.3)
. (1.3)
в) Шкала Кельвина: температура Т отсчитывается от абсолютного нуля (t = -273,15°С) и называется абсолютной температурой. Связь между значениями температуры по шкале Кельвина (Т °К) и шкале Цельсия (t°С) имеет вид:
Т °К = t °С + 273,15°С.
Внутренние параметры термодинамической системы, находящейся в равновесном состоянии, зависят только от ее внешних параметров и от температуры:
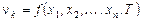 , (1.4)
, (1.4)
где 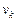 - внутренний параметр,
- внутренний параметр, 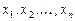 - внешние параметры.
- внешние параметры.
Например, равновесное состояние физически однородной термодинамической системы в соответствии с правилом фаз Гиббса полностью определяется двумя параметрами. Поэтому равновесное давление в этой системе является функцией ее объема и температуры (масса системы предполагается фиксированной):
 . (1.5)
. (1.5)
Если в уравнении (1.4)  представляет собой обобщенную силу, сопряженную какому-либо из внешних параметров x 1,¼, x n, то уравнение (1.4) называется термическим уравнением состояния системы (уравнением состояния системы), Например, уравнение (1.5) - термическим уравнением состояния физически однородной системы.
представляет собой обобщенную силу, сопряженную какому-либо из внешних параметров x 1,¼, x n, то уравнение (1.4) называется термическим уравнением состояния системы (уравнением состояния системы), Например, уравнение (1.5) - термическим уравнением состояния физически однородной системы.
Уравнение (1.4), записанное для внутренней энергии U системы:
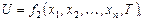 (1.6)
(1.6)
называется калорическим уравнением состояния системы. В ермодинамике уравнения состояния исследуемой системы предполагаются известными из опыта. Теоретический вывод этих уравнений может быть осуществлен методами статистической физики.
Date: 2015-05-09; view: 1274; Нарушение авторских прав