
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уравнения состояния
|
|
При выводе основных уравнений состояния в термодинамике в качестве рабочего тела рассматривается идеальный газ. Под идеальным условно понимается газ, у которого отсутствуют силы взаимодействия между молекулами, а сами молекулы рассматриваются как лишенные объема, хотя они являются материальными частицами. Понятие “идеальный газ” упрощает термодинамические исследования и обеспечивает при низких давлениях и высоких температурах приемлемую точность результатов.
Рассматриваемые ниже закономерности справедливы для идеальных газов.
Для 1 кг идеального газа уравнение состояния имеет вид
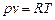 ,
,
где р - давление, Па; v - удельный объем, м3/кг; Т - абсолютная температура, К; R - удельная газовая постоянная, Дж/кг×К.
Для m кг газа, если учесть, что 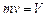 , уравнение состояния идеального газа получает вид
, уравнение состояния идеального газа получает вид
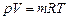 ,
,
где V - объем m кг газа, м3.
Для 1 кмоля уравнение состояния имеет вид
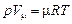
где Vm - объем 1 кмоля газа, м3/кмоль; 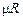 - универсальная газовая постоянная, численно равная работе, совершаемой 1 кмолем идеального газа при нагревании на один градус, Дж/кмоль×К.
- универсальная газовая постоянная, численно равная работе, совершаемой 1 кмолем идеального газа при нагревании на один градус, Дж/кмоль×К.
Уравнение состояния идеального газа, записанное для разных количеств в трех видах называется также характеристическим уравнением Клапейрона - Менделеева, как полученное вначале для 1 кг Клапейроном, а затем обобщенное Менделеевым. Исторически физические законы Бойля-Мариотта и Гей-Люссака появились раньше, чем уравнение состояния, однако их можно рассматривать как его частные случаи. Действительно, если Т = cons t, то из первого уравнения состояния получаем
 или
или 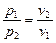 .
.
Эти уравнения выражают собой закон Бойля-Мариотта. Если 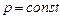 , то для двух состояний газа можем записать,
, то для двух состояний газа можем записать,
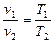 - Закон Гей-Люссака.
- Закон Гей-Люссака.
Удельная газовая постоянная R для каждого газа при любых условиях сохраняет свое определенное значение. Для определения газовой постоянной воспользуемся тем, что объемы 1 кмоля идеальных газов при одинаковых температурах и давлении приблизительно одинаковы. При нормальных условиях 1 кмоль всех идеальных газов равен 22,414 м3/кмоль. Приняв нормальные условия и подставив значения параметров для них в выражение для R, найдем
 Дж/кмоль×К,
Дж/кмоль×К,
т.е. универсальная газовая постоянная одинакова для всех газов. Так как 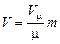 , то подставив значение молярного объема Vm в основное уравнение состояния идеального газа, получим
, то подставив значение молярного объема Vm в основное уравнение состояния идеального газа, получим
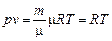 ,
,
где 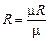 - удельная газовая постоянная, Дж/кг×К.
- удельная газовая постоянная, Дж/кг×К.
Удельная газовая постоянная численно равна работе, которую совершает 1 кг идеального газа при нагревании его на один градус. Между универсальной газовой постоянной R и удельной газовой постоянной существует связь
 Дж/кмоль×К.
Дж/кмоль×К.  кг/м3,
кг/м3,
а удельный объем 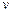 по обратной формуле
по обратной формуле
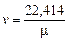 м3/кг,
м3/кг,
где Vm = 22,414 м3/кмоль - объем 1 кмоля идеального газа.
С помощью уравнения состояния можно решать задачи по определению массы некоторого количества газа или какого-либо его параметра, если заданы остальные.
Пример 1.1. Определить массу кислорода, содержащегося в баллоне вместимостью V = 0,08 м3 при t = 27°С и р = 2,5 МПа.
Р е ш е н и е. Определим удельную газовую постоянную для газа кислорода
 Дж/кг×град.
Дж/кг×град.
Определим абсолютную температуру
Т = t + 273 = 27 + 273 = 300°К.
Из уравнения состояния находим
 кг.
кг.
Пример 1.2. Паротурбинная установка мощностью 500000 кВт расходует 335 г условного топлива на 1 кВт×ч. Определить массу воздуха, которую необходимо подать в топку котла за 1 ч, если для сжигания 1 кг топлива требуется 16 м3 воздуха при давлении 750 мм рт. ст. (100 кПа), приведенном к 0°С и температуре 15°С.
Р е ш е н и е. За 1 час работы котла требуется топлива:
500000´0,335 = 167500 кг.
На каждый 1 кг топлива необходимо подать в топку котла 16 м3 воздуха, или за 1 час работы требуется воздуха:
167500´16 = 2680000 м3.
Масса этого объема воздуха составит
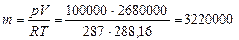 кг = 3220 т/ч.
кг = 3220 т/ч.
Date: 2015-05-09; view: 1411; Нарушение авторских прав