
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реакции первого порядка
|
|
Вспомним уравнение 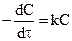 (уравнение для одномолекулярных реакций), разделим переменные и получим
(уравнение для одномолекулярных реакций), разделим переменные и получим 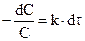 , интегрируя его, получаем:
, интегрируя его, получаем:
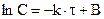 .
.
Обозначая через С0 начальную концентрацию при τ=0, определяем постоянную интегрирования 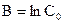 . Отсюда
. Отсюда
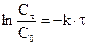 или
или 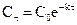 ,
,
где 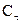 - концентрация вещества к моменту времени τ.
- концентрация вещества к моменту времени τ.
Для кинетики реакций первого порядка характерно, что в левой части уравнения содержится только отношение концентраций. Изменение обеих концентраций в одинаковое число раз не меняет промежутка времени τ. Следовательно, если в одном опыте концентрация через n минут станет вдвое меньше начальной, то и в других опытах (при других начальных концентрациях) в данной реакции она за n минут уменьшится тоже в два раза. Это означает, что за одинаковые промежутки времени прореагирует одинаковая доля взятого количества исходного вещества. Например, если за первые 10 минут в реакцию вступило 5 % от взятого количества вещества, то за следующие 10 минут прореагируют 5 % от оставшихся 95 % исходного вещества.
Для характеристики скорости реакций первого порядка наряду с константой скорости часто пользуются величиной, называемой периодом полураспада τ1/2, равным промежутку времени, в течение которого реагирует половина взятого количества вещества. Из уравнения 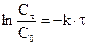 или
или 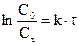 , принимая, что
, принимая, что 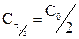 , следует, что
, следует, что 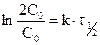 , следовательно,
, следовательно, 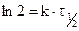 или для константы равновесия имеем
или для константы равновесия имеем 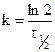 . Если решить данное уравнение для периода полураспада, то имеем
. Если решить данное уравнение для периода полураспада, то имеем 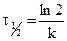 , из данного уравнения следует, что период полураспада в реакциях первого порядка не зависит от начальной концентрации реагирующего вещества и определяется только константой скорости реакции k. Принимая во внимание, что
, из данного уравнения следует, что период полураспада в реакциях первого порядка не зависит от начальной концентрации реагирующего вещества и определяется только константой скорости реакции k. Принимая во внимание, что 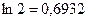 , получаем, что
, получаем, что 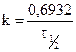 . Это соотношение показывает, что константа скорости реакции первого порядка обратно пропорциональна периоду полураспада.
. Это соотношение показывает, что константа скорости реакции первого порядка обратно пропорциональна периоду полураспада.
Зависимость константы скорости только от отношения концентраций позволяет заменять их при расчете другими пропорциональными величинами. Часто вместо концентраций используют отношение количеств вещества, а в газовых реакциях – отношение давлений.
Date: 2015-05-09; view: 893; Нарушение авторских прав