
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энтропия – мера рассеивания энергии в окружающую среду, т.е. та часть энергии, которая в полезную работу не превращается!!!
|
|
Все изложенное выше находит отражение в формулировках второго закона термодинамики:
1.Тепло не может самопроизвольно переходить от более холодного к более теплому телу (Клаузиус).
2.Невозможно создать вечный двигатель второго рода, т.е. такую тепловую машину, в которой бы теплота полностью переходила в работу.
3.Любая система, представленная сама себе, будет изменяться в направлении состояния, отвечающего максимальной вероятности (Льюс).
4. Энтропия изолированной системы увеличивается или остается постоянной

> для самопроизвольных необратимых процессов
= для обратимых процессов.
В последней четвертой формулировке заключен критерий самопроизвольности процессов в изолированных системах: спонтанно в такой системе могут протекать те процессы, которые сопровождаются увеличением энтропии (перемешивание газов, выравнивание температур и давлений).
2.1 расчет изменения энтропии в обратимых процессах
(равновесных процессах)
1. Нагревание веществ от Т1 до Т2 (неизотермический процесс)
Уравнения для вычисления DS изобарного (P=const) и изохорного (V=const) нагревания 1 моля веществ имеют вид:
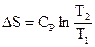 и
и 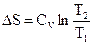 .
.
Для n молей: 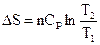 и
и 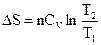 .
.
2. Изотермическое расширение газа, объем которого изменяется при некоторой температуре Т от V1 до V2:
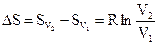 .
.
Для n молей: 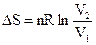
3. Изменение энтропии фазовых переходов вычисляется по уравнению
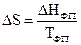 ,
,
где 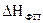 - теплота фазового перехода,
- теплота фазового перехода, 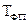 - температура фазового перехода.
- температура фазового перехода.
Например, теплота фазового перехода воды из жидкого состояния в парообразное (процесс испарения) составляет около 41 кДж/моль. Следовательно, изменение энтропии составляет:
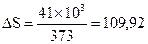 Дж/моль·К.
Дж/моль·К.
4. Изменение энтропии химических реакций, протекающих в изотермических условиях, вычисляется как разность сумм энтропий конечных и исходных веществ участвующих в реакции
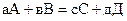 .
.
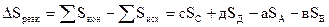 ,
,
где SC, SД, SA, SB - абсолютные энтропии веществ - участников реакции; а, в, с, д - стехиометрические коэффициенты.
Абсолютные значения энтропий веществ вычислены для стандартных условий протекания реакций и представлены в термодинамических справочниках.
Определение абсолютных энтропий веществ стало возможным после формулировки постулата Планка, который позволил определить начало отсчета энтропии - состояния с минимальной энтропией при абсолютном нуле температуры.
Постулат Планка составляет содержание 3 - го закона термодинамики и формулируется так:
«Энтропия полностью упорядоченных кристаллических тел при температуре абсолютного нуля равна 0».
S0К =0, тогда 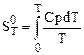 .
.
Стандартная энтропия индивидуальных веществ (So298) имеют размерность Дж/моль×К, т.е. это количество теплоты, которое рассеивается в окружающую среду, если моль вещества нагревается на 1о.
Date: 2015-05-09; view: 1083; Нарушение авторских прав