
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическим сродством называется способность различных веществ реагировать друг с другом
|
|
Количественной мерой химического сродства является изменение функций DF и DG для процессов (реакций), протекающих при постоянных V и Т и Р и Т, соответственно.
Величины DF и DG не зависят от пути процесса, а зависят только от свойств реагирующих веществ и их термодинамического состояния; знак DF и DG определяют направление процесса; при равновесии эти функции имеют минимальное значение, а их изменение (уменьшение) при переходе из химически неравновесного в равновесное состояние равно максимальной работе обратимого процесса и, наконец, эти величины (DF и DG) можно рассчитать с помощью уравнений изотермы Вант-Гоффа.
Для того, чтобы в одинаковых условиях сравнивать устойчивость химических соединений, реакционную способность веществ ввели понятие стандартного химического сродства.
Стандартным химическим сродством называется сродство, которое имеет место, когда исходные парциальные давления или концентрации каждого вещества, принимающего участие в реакции, равны единице.
В этом случае член lnП в уравнениях изотермы становится равным 0 и выражение для стандартного химического сродства имеет вид
DFo= -RTlnKc; DGo= -RTlnKp.
Сравнивая DGo (DFo) разных реакций, можно оценить степень удаления смесей веществ при Рi=1 или Сi=1 от равновесного состояния.
Для оценки химического сродства чаще пользуются величиной DGo реакции, протекающей при стандартной температуре 298 К. Величины 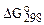 образования веществ являются критерием прочности химических соединений. Вещество тем прочнее, чем изменение стандартной энергии Гиббса его образования величина более отрицательна.
образования веществ являются критерием прочности химических соединений. Вещество тем прочнее, чем изменение стандартной энергии Гиббса его образования величина более отрицательна.
Например: 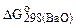 = -527934 Дж,
= -527934 Дж,
 = -362615 Дж.
= -362615 Дж.
Более прочным из двух оксидов является ВаО, т.к. 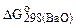 более отрицательна, чем
более отрицательна, чем  .
.
Если требуется оценить 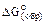 вещества при температуре, отличной от стандартной, то можно воспользоваться уравнением температурной зависимости, приводимыми в ряде справочников.
вещества при температуре, отличной от стандартной, то можно воспользоваться уравнением температурной зависимости, приводимыми в ряде справочников.
Например: 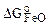 = -232160 + 45,31×Т, Дж/моль
= -232160 + 45,31×Т, Дж/моль
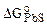 = -144210 + 72,21× Т, Дж/ моль.
= -144210 + 72,21× Т, Дж/ моль.
Расчет стандартного химического сродства при температурах Т, отличных от стандартной, осуществляется с учетом температурных зависимостей изменения функций DН и DS химических реакций по уравнению
 .
.
Для оценки химического сродства при заданных давлениях (концентрациях) участников реакций, отличных от стандартных значений, пользуются уравнением изотермы Вант-Гоффа,
Таким образом, величина константы равновесия может быть определена по уравнению: 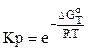 . В свою очередь
. В свою очередь 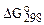 может быть рассчитано:
может быть рассчитано:
1. С использованием 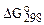 (образования) веществ, участвующих в реакции по уравнению
(образования) веществ, участвующих в реакции по уравнению
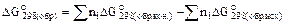
2. С использованием таблиц стандартных термодинамических характеристик веществ по уравнению Гиббса - Гельмгольца
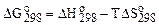 .
.
Одновременно уравнение Гиббса-Гельмгольца показывает, как влияет температура на 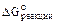 .
.
Возможно несколько ситуаций:
Условия протекания экзотермических реакций: DH<0. При этом возможность условия самопроизвольного протекания реакции определяется знаком DG = DH – TDS
Рассмотрим, как меняется знак DG при варьировании величины DS.
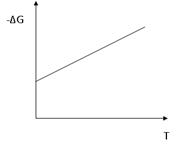 а) Если DS>0, то DG = DH – TDS<0. Процесс идет самопроизвольно. Например, протекание реакции
а) Если DS>0, то DG = DH – TDS<0. Процесс идет самопроизвольно. Например, протекание реакции 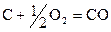 в этом случае DS>0, т.к. процесс протекает с увеличением числа молей газообразных веществ (вспомним, что
в этом случае DS>0, т.к. процесс протекает с увеличением числа молей газообразных веществ (вспомним, что 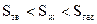 ). Следовательно, при DH<0 и DS>0 значение DG приобретает более отрицательное значение и реакция идет самопроизвольно в прямом направлении (рис. 14).
). Следовательно, при DH<0 и DS>0 значение DG приобретает более отрицательное значение и реакция идет самопроизвольно в прямом направлении (рис. 14).
б) Если DS=0, то DG = DH – TDS<0. Процесс идет самопроизвольно.
в) Если DS<0, то DG = DH – TDS может иметь различные знаки в зависимости от абсолютной величины TDS:
·. 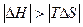 . При этом DG<0. Процесс идет самопроизвольно.
. При этом DG<0. Процесс идет самопроизвольно.
· 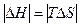 При этом DG=0. Состояние равновесия.
При этом DG=0. Состояние равновесия.
· 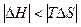 При этом DG>0. Процесс не идет слева направо. Например, протекание реакции
При этом DG>0. Процесс не идет слева направо. Например, протекание реакции 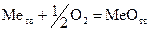 в этом случае DS<0, т.к. процесс протекает с уменьшением числа молей газообразных веществ, следовательно, DG приобретает более положительное значение и реакция самопроизвольно в прямом
в этом случае DS<0, т.к. процесс протекает с уменьшением числа молей газообразных веществ, следовательно, DG приобретает более положительное значение и реакция самопроизвольно в прямом 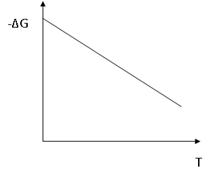 направлении не идет (рис.15).
направлении не идет (рис.15).
Таким образом, экзотермические реакции термодинамически запрещены только при значительном уменьшении энтропии, например, в некоторых процессах структурирования, образования дополнительных связей и т.д.
Условия протекания эндотермических реакций (DH>0). При этом возможность условия самопроизвольного протекания реакции определяется знаком DG = DH – TDS
Как и в предыдущем случае, рассмотрим, как меняется знак DG при варьировании величины DS.
а) Если DS>0, то DG = DH – TDS может иметь различные знаки в зависимости от абсолютной величины TDS:
· DH < TDS. При этом DG<0. Процесс идет самопроизвольно.
· DH = TDS. При этом DG=0. Состояние равновесия.
· DH > TDS. При этом DG>0. Процесс не идет самопроизвольно слева направо.
б) Если DS=0, то DG = DH – TDS>0. Процесс не идет самопроизвольно слева направо.
в) Если DS<0, то DG = DH – TDS >0. Процесс не идет самопроизвольно слева направо.
Кинетика гомогенных процессов
Кинетикой химических реакций называется учение о скорости их протекания, механизме химического взаимодействия и зависимости их от различных факторов (например, таких как, концентрация реагирующих веществ, температура, влияние катализаторов и т.п.). Эти вопросы представляют большой практический и теоретический интерес и являются центральными при изучении данного раздела. Известно, что разные реакции совершаются с самыми различными скоростями. Некоторые, такие как реакции разложения взрывчатых веществ, заканчиваются в доли секунды; другие продолжаются минутами, часами, днями, а третьи, например, некоторые процессы, совершающиеся в земной коре, растягиваются на десятки, сотни и тысячи лет. Кроме того, большое различие существует не только в скоростях разных реакций, но и скорость какой-нибудь данной реакции может очень значительно меняться в зависимости от условий, в которых она происходит.
При практическом использовании от скорости реакции, применяемой в каком-нибудь производственном процессе, будет зависеть производительность аппарата и, следовательно, количество вырабатываемой продукции. Поэтому очень важно знать, с какой скоростью будет совершаться та или иная реакция в данных условиях и как нужно изменить эти условия, чтобы она протекала с желательной скоростью. Теоретическое значение вопросов кинетики заключается в том, что изучение их позволяет выяснить многие важные детали химических процессов и глубже понять механизм взаимодействия веществ.
Физическая химия изучает системы с позиций термодинамики и кинетики. Сравнивая начальные и конечные состояния системы, термодинамика предсказывает возможность протекания реакции, а не действительный переход безотносительно ко времени, за которое он может произойти. Несовпадение, в большинстве случаев, возможного и действительного объясняют двумя причинами:
1. Результат термодинамического анализа (DG) является вероятностным, так как в него входит вероятностная функция - энтропия.
2. Переход системы из одного состояния в другое связан зачастую с преодолением энергетического барьера, тем большего, чем ниже температура перехода.
Таким образом, термодинамический анализ, позволяющий оценить возможность процесса, должен быть дополнен кинетическим, который позволяет оценить скорость процесса, возможность которого доказана термодинамическим расчетом!!!
зависимость скорости реакции от концентрации реагирующих веществ
При количественном рассмотрении скорость химической реакции принято характеризовать изменением концентрации реагирующих веществ в единицу времени. По существу безразлично, концентрацию какого из реагирующих веществ рассматривать. Концентрации исходных веществ будут уменьшаться, а получаемых — возрастать. Обычно скорость химической реакции при постоянных внешних условиях не остается постоянной, а изменяется во времени. Это изменение можно отобразить с помощью графической зависимости, приведенной на рисунке. Очевидно, что по мере расходования исходных веществ скорость протекания процесса уменьшается. В связи с этим численные значения скорости реакции будут различными в определенный промежуток или интервал времени.
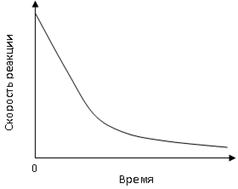
Различают среднюю скорость реакции и истинную скорость.
При определении средней скорости реакции за данный промежуток времени оперируют конечным изменением концентрации 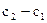 , относящимся к промежутку времени
, относящимся к промежутку времени 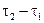 :
:
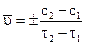 .
.
Далее мы будем оперировать только истинными скоростями реакции, которые определяются отношением изменения концентрации к бесконечно малому промежутку времени, или иначе, как производная от концентрации по времени:
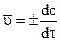 .
.
Скорость реакции всегда считается положительной. Отношение 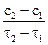 и производная
и производная 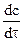 могут быть как положительными, так и отрицательными в зависимости от того, представляет ли «с» концентрацию одного из исходных или одного из продуктов реакции. Допустим, протекает химическая реакция:
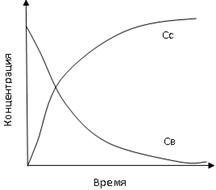
могут быть как положительными, так и отрицательными в зависимости от того, представляет ли «с» концентрацию одного из исходных или одного из продуктов реакции. Допустим, протекает химическая реакция: 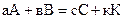 , согласно рисунку, кривая св, характеризующая изменение концентрации исходного вещества В, убывает во времени, таким образом,
, согласно рисунку, кривая св, характеризующая изменение концентрации исходного вещества В, убывает во времени, таким образом, 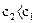 и
и 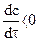 , следовательно, чтобы скорость была величиной положительной необходимо в правой части уравнения брать знак «минус». Если же «с» представляет концентрацию одного из получаемых веществ, кривая сс, то наблюдается противоположная картина, концентрация получаемого вещества возрастает во времени, таким образом,
, следовательно, чтобы скорость была величиной положительной необходимо в правой части уравнения брать знак «минус». Если же «с» представляет концентрацию одного из получаемых веществ, кривая сс, то наблюдается противоположная картина, концентрация получаемого вещества возрастает во времени, таким образом, 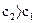 и
и 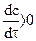 . Следовательно, в правой части уравнения нужно брать знак «плюс».
. Следовательно, в правой части уравнения нужно брать знак «плюс».
Допустим, рассматриваемая нами реакция обусловлена взаимодействием только газообразных веществ. Очевидно, что необходимым условием, определяющим возможность взаимодействия между двумя молекулами, является их взаимное столкновение, т.е. сближение до такого расстояния, при котором электроны и атомы одной молекулы попадают в сферу действия электрических полей, возбуждаемых частицами другой молекулы. Только при таких условиях могут произойти те переходы электронов и перегруппировки атомов, в результате которых образуются новые молекулы.
Конечно, не каждое столкновение приводит к такому взаимодействию. Число столкновений, испытываемых каждой молекулой газа в обычных условиях, очень велико и достигает десятков миллиардов в секунду. Отсюда следует, что в реакциях, протекающих с конечными скоростями (а не мгновенно), к взаимодействию приводит только какая-то малая часть столкновений. Возможность и вероятность химического взаимодействия будет зависеть от состояния молекул (полярность) в момент столкновения и от длительности самого столкновения.
Независимо от того, какие именно столкновения сопровождаются взаимодействием, можно принять, что при постоянных внешних условиях некоторая постоянная доля (часть) столкновений является эффективной для взаимодействия. Поэтому чем больше будет происходить столкновений, тем, при прочих равных условиях, больше будет число случаев взаимодействия, а, следовательно, и количество образовавшегося нового вещества, т. е. тем скорее будет протекать реакция.
Число столкновений должно увеличиваться с повышением концентрации реагирующих веществ. Для наиболее простых по кинетике гомогенных реакций опыт показывает, что зависимость скорости процесса от концентраций реагентов, в общем виде выражают в форме основного постулата кинетики - ОПК
при постоянной температуре скорость данной реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени, в простейших случаях равной коэффициенту перед формулой данного вещества в уравнении реакции.
Этим правилом и определяется влияние концентрации на скорость реакции. Оно было выражено (в несколько иной форме) впервые Гульдбергом и Вааге (1867). Его также называют законом действия масс, как и закон, выражающий константу равновесия реакции, они тесно связаны между собой. Для газовых реакций это правило является строгим только в пределах применимости законов идеальных газов. Оно применимо также и к реакциям в разбавленных растворах (строго только для бесконечно разбавленных растворов). В математической форме в применении, например, к реакции
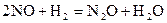
оно выражается в виде:
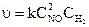 ,
,
где k- коэффициент пропорциональности, который для каждой конкретной, т.е. данной реакции при T=const является величиной постоянной и называется константой скорости реакции. Он численно равен скорости реакции в условиях, когда концентрация каждого из исходных веществ равна единице.
кинетическая классификация химических реакций
В отношении кинетики химические реакции классифицируют по двум признакам:
- по признаку молекулярности реакции;
- по признаку порядка реакции.
Молекулярность реакции определяется числом молекул, одновременным взаимодействием между которыми осуществляется акт химического превращения.
По этому признаку реакции разделяются на:
- одномолекулярные (или мономолекулярные);
- двухмолекулярные (или бимолекулярные);
- трехмолекулярные (или тримолекулярные).
Можно говорить и о более высокой молекулярности, но в действительности одновременное столкновение трех молекул уже является очень маловероятным и трехмолекулярные реакции встречаются крайне редко. Реакций же более высокой молекулярности практически неизвестно.
К одномолекулярным реакциям относятся некоторые реакции разложения молекул и внутримолекулярных перегруппировок. Например, газовая реакция:
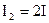 .
.
Для простых (элементарных) одномолекулярных реакций зависимость скорости реакции от концентрации описывается уравнением:
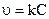 ,
,
где С – концентрация исходного вещества. Или иначе можно записать, что
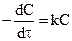 .
.
Здесь k имеет размерность обратного времени, выражается в с-1, мин-1 или других соответствующих единицах.
К двухмолекулярным реакциям относятся такие, реализация которых происходит при столкновении двух молекул различного или одинакового типа:
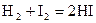 или
или 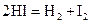 .
.
Для таких реакций:
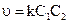 ,
,
где 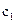 и
и 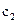 - концентрации исходных веществ.
- концентрации исходных веществ.
Для таких реакций:
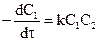 .
.
В частном случае, когда 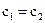 , имеем:
, имеем:
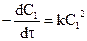 .
.
Для двухмолекулярных реакций константа скорости k имеет размерность 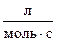 или
или 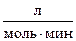 .
.
По аналогии, к трехмолекулярным реакциям относят реакции, в которых для взаимодействия необходимо одновременное столкновение трех молекул одного или различного видов. В общем случае уравнение скорости простых (элементарных) трехмолекулярных реакций имеет вид:
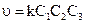 .
.
Примером трехмолекулярной реакции рассмотренная ранее реакция 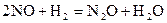 .
.
Порядок реакции определяется по виду уравнения, выражающего зависимость скорости реакции от концентрации реагирующих веществ. Порядок реакции равен сумме показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентраций реагирующих веществ. Реакции разделяются на реакции:
- первого порядка,
- второго порядка,
- третьего порядка (реакции более высоких порядков не встречаются).
Кроме того, известны так называемые реакции нулевого порядка и некоторые реакции, порядок которых выражается дробным числом. Таким образом, порядок химической реакции изменяется от 0 до 3, может принимать дробное значение!
Прежде такое распределение считали совпадающим с делением по признаку молекулярности, т.е. все одномолекулярные реакции являются реакциями первого порядка, и наоборот, а все двухмолекулярные реакции являются реакциями второго порядка, и наоборот. Однако экспериментальные исследования внесли свои коррективы.
Скорость химической реакции определяется совокупностью огромного числа элементарных актов взаимодействия между молекулами (или атомами, или ионами). Акты эти могут быть одинаковыми (в простых реакциях) или различными, происходящими параллельно или последовательно.
Кроме того, в некоторых случаях один из компонентов реакции присутствует в таком большом избытке, что расход его в реакции практически не отражается на его концентрации. В результате кинетика этой реакции описывается, например, уравнениями кинетики реакции первого порядка, хотя реакция является по существу бимолекулярной.
Реакциями нулевого порядки называют процессы, в которых скорость процесса сохраняется постоянной во времени. Это встречается в некоторых гетерогенных системах (например, если применять эфир, малорастворимый в воде, и взять его в избытке, чтобы в системе присутствовал эфирный слой, то расход эфира будет постоянно восполняться из эфирного слоя. Таким образом, концентрация его в водном слое будет постоянной и, следовательно, постоянной будет скорость процесса 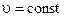 ).
).
Date: 2015-05-09; view: 2748; Нарушение авторских прав