
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Для гетерогенной реакции
|
|
Гетерогенными называются реакции, в которых реагенты находятся в разных агрегатных состояниях. При этом для таких реакций с участием газов, когда не образуются твердые и жидкие растворы, в записи закона действующих масс участвуют только равновесные действующие массы газообразных компонентов. Например,
3Fe(тв) + СН4(газ) = Fe3C(тв) + 2Н2(газ)
условия равновесия DG = 0 выполняются если
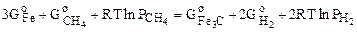
из которого следует
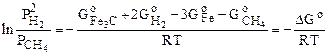 .
.
При Т=const правая часть этого уравнения - величина постоянная, а выражение 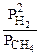 равно константе равновесия данной гетерогенной реакции
равно константе равновесия данной гетерогенной реакции
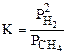
где 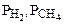 - равновесные парциальные давления газов.
- равновесные парциальные давления газов.
Для реакции СО2 + СО Û 2СО константа равновесия Кр и Кс запишутся так
 ,
, 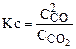 .
.
Если же вещества, участвующие в реакции растворяются друг в друге или в каких-то инертных растворителях, роль которых в пирометаллургических процессах могут играть шлаковые или металлические фазы, то в константу равновесия записываются их равновесные концентрации или термодинамические активности.
Например,
[FeO]+[C]=[Fe]+CO
Квадратная скобка [ ] указывает, что данное вещество
является компонентом металлической фазы
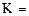
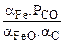
aFe, aFeO, aC - термодинамические активности Fe, FeO и C в расплаве (жидкой стали).
Для реакции
(MgCl2)+CaC2=(CaCl2)+Mgпар+2Cтв
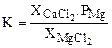 .
.
Круглые скобки () указывают, что MgCl2 и CaCl2 являются компонентами шлаковой (солевой) фазы. 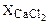 ,
, 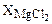 - мольные доли CaCl2 и MgCl2 в солевом расплаве.
- мольные доли CaCl2 и MgCl2 в солевом расплаве.
Константа равновесия зависит от температуры и природы веществ.
3.2 влияние температуры на константу равновесия
Практически любой технологический процесс проводится в условиях, отличных от стандартных (Т = 298,16 К, Р = 1 атм). Поэтому при проведении реальных термодинамических расчетов необходимо знать температурную зависимость (закон изменения) константы равновесия. Это позволит установить влияние температуры на изменение парциальных давлений (или концентраций) компонентов и определить направление смещения равновесия изучаемой реакции или процесса.
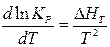
и называется уравнением изобары Вант-Гоффа. Аналогично можно получить уравнение зависимости константы равновесия от температуры для изохорических условий. В этом случае уравнение изохоры Вант-Гоффа имеет вид: 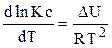 . Так как чаще всего металлургические процессы протекают при постоянном давлении, то чаще всего для анализа зависимости используют уравнение изобары. Проанализируем уравнение изобары, преобразовав его в интегральную форму. Если расчеты производятся для небольшого интервала температур, то тепловой эффект реакции DH в уравнении изобары можно считать величиной постоянной. Тогда это уравнение в интегральной форме будет иметь вид:
. Так как чаще всего металлургические процессы протекают при постоянном давлении, то чаще всего для анализа зависимости используют уравнение изобары. Проанализируем уравнение изобары, преобразовав его в интегральную форму. Если расчеты производятся для небольшого интервала температур, то тепловой эффект реакции DH в уравнении изобары можно считать величиной постоянной. Тогда это уравнение в интегральной форме будет иметь вид:
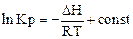 . (**)
. (**)
 Согласно уравнению, влияние температуры на константу равновесия обуславливается знаком теплового эффекта. При положительных значениях
Согласно уравнению, влияние температуры на константу равновесия обуславливается знаком теплового эффекта. При положительных значениях 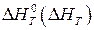 (т.е. протекает эндотермическая реакция)
(т.е. протекает эндотермическая реакция) 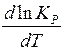 положительно и константа равновесия возрастает с повышением температуры. В случае экзотермической реакции – наоборот. Это говорит о том, что при изменении температуры давления (концентрации) компонентов при равновесии изменяются. Данный общий принцип, отражающий влияние различных факторов на положение равновесия, носит название принципа смещения равновесий или принципа Ле-Шателье, с которым мы уже встречались при рассмотрении вопросов подвижности равновесия:
положительно и константа равновесия возрастает с повышением температуры. В случае экзотермической реакции – наоборот. Это говорит о том, что при изменении температуры давления (концентрации) компонентов при равновесии изменяются. Данный общий принцип, отражающий влияние различных факторов на положение равновесия, носит название принципа смещения равновесий или принципа Ле-Шателье, с которым мы уже встречались при рассмотрении вопросов подвижности равновесия:
если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
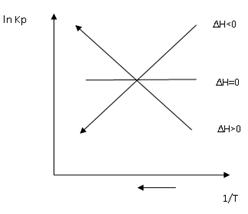
Из уравнения Вант-Гоффа следует, что для определения температурной зависимости константы равновесия любой химической реакции необходимо знать температурную зависимость теплового эффекта 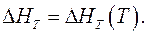 Степень влияния температуры на константу равновесия реакции зависит от абсолютного значения теплового эффекта: чем больше DН, тем сильнее влияет температура на Кр.
Степень влияния температуры на константу равновесия реакции зависит от абсолютного значения теплового эффекта: чем больше DН, тем сильнее влияет температура на Кр.
На рис. представлена температурная зависимость константы равновесия реакции в координатах lnKp - 1/T в виде прямых линий.
Определив Кр реакции при двух температурах (Т1 и Т2), можно рассчитать тепловой эффект реакции (DН), решая совместно уравнение (**) для двух температур:
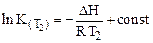 ,
,
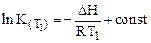 .
.
И вычитая одно уравнение из другого, получим
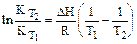 , откуда
, откуда 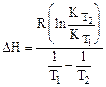 .
.
По уравнению 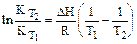 по известной величине К при какой-то из двух температур Т1 или Т2 и DНреакции можно найти К при другой температуре
по известной величине К при какой-то из двух температур Т1 или Т2 и DНреакции можно найти К при другой температуре 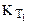 или
или 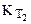 .
.
3.3 уравнение изотермы вант-гоффа
Химическая термодинамика позволяет расчетным путем определить полезную работу химической реакции через изменение функции DF и DG и тем самым судить о направлении химического процесса.
Вант-Гофф вывел уравнение изотермы реакции, которое носит его имя и связывает изменение функций DF и DG с константой равновесия реакции и парциальными давлениями или концентрациями веществ, участвующих в реакции.
Уравнение изотермы Вант-Гоффа имеет вид:
для реакций, протекающих в изохорных условиях: 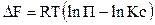
для реакций, протекающих в изобарных условиях: 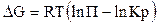
где DF - изменение энергии Гельмгольца реакции, DG - изменение энергии Гиббса реакции, Кр, Кс - константы равновесия химических реакций, П - константа ²неравновесия² химических реакций.
Проанализируем уравнение изотермы Вант-Гоффа для изобарных процессов как наиболее часто встречающиеся на практике.
Возьмем реакцию, где все участники – газы:
аА + bB = dD + rR
Для реакции, протекающей в изобарных условиях, уравнение изотермы примет вид
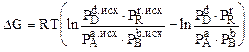 , где
, где 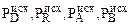 - парциальные давления газов в исходной реакционной смеси, PD, PR, PA, PB - парциальные давления газов в равновесной газовой смеси.
- парциальные давления газов в исходной реакционной смеси, PD, PR, PA, PB - парциальные давления газов в равновесной газовой смеси.
Поскольку 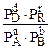 = Кр, то при Т=const эта величина является величиной постоянной, а константа неравновесия П=
= Кр, то при Т=const эта величина является величиной постоянной, а константа неравновесия П= 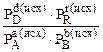 - величина переменная, зависящая от значений исходных давлений реагентов.
- величина переменная, зависящая от значений исходных давлений реагентов.
Если 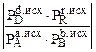 < Кр, то DG<0, реакция протекает в прямом направлении;
< Кр, то DG<0, реакция протекает в прямом направлении;
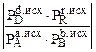 > Кр, то DG>0, реакция протекает в обратном направлении;`
> Кр, то DG>0, реакция протекает в обратном направлении;`
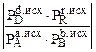 = Кр, то DG=0, система находится в состоянии равновесия.
= Кр, то DG=0, система находится в состоянии равновесия.
3.4 методы определения константы равновесия. стандартное химическое сродство
Существует несколько методов определения константы равновесия:
1. Константа равновесия может быть определена из опытных данных. Можно провести термодинамический процесс (осуществить химическую реакцию) и измерить равновесные давления реагентов. Путь сложный, но иногда используется.
2. Константу равновесия определяют по величинам стандартных электродных потенциалов и ЭДС гальванического элемента. 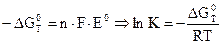
3. Определяют по величине произведения растворимости.
4. Так называемый энтропийный метод: для этого используют уравнение нормального химического сродства.
Date: 2015-05-09; view: 1059; Нарушение авторских прав