
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Внутренняя энергия – это сумма всех видов энергий, которыми обладают частицы, составляющие систему
|
|
В соответствии с характером движения частиц внутри системы, основными составляющими внутренней энергии являются:
кинетическая и вращательная энергия;
энергия взаимодействия;
энергия внутримолекулярного колебательного движения атомов и атомных групп, образующих молекулы;
энергия вращения электронов в атомах;
внутриядерная энергия и т. д.
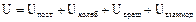
На ее значение не влияет перемещение системы в пространстве как целого (кинетическая энергия движения системы) и потенциальная энергия пространственного расположения.
Абсолютная величина внутренней энергии любой, произвольно взятой системы неизвестна, и практически не поддается расчету в связи с неопределенностью начала отсчета, для которого 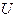 = 0 (из-за сложности превращений микрочастиц внутри ядра). Однако для целей термодинамики этого и не требуется. Термодинамика использует изменение внутренней энергии DU (DU = U2 - U1). Индекс 1 соответствует начальному, а индекс 2 – конечному состоянию процесса.
= 0 (из-за сложности превращений микрочастиц внутри ядра). Однако для целей термодинамики этого и не требуется. Термодинамика использует изменение внутренней энергии DU (DU = U2 - U1). Индекс 1 соответствует начальному, а индекс 2 – конечному состоянию процесса.
Величина DU положительна, если в процессе внутренняя энергия возрастает. Изменение внутренней энергии DU зависит только от параметров состояния (р, Т, V и др.), поэтому внутренняя энергия является функцией состояния системы. Функциями состояния называются термодинамические функции, которые зависят только от начального и конечного состояния системы и не зависят от пути, по которому это состояние получено (к функциям состояния относят, например, внутреннюю энергию, энтальпию, энергию Гельмгольца, энергию Гиббса, энтропию).
Внутренняя энергия может изменяться за счет обмена энергией с окружающей средой. Возможные формы передачи энергии - работа А и теплота q. Они зависят от пути перехода системы из начального состояния в конечное, и, следовательно, не являются функциями состояния.
Передача теплоты или совершение работы осуществляются только при взаимодействии системы с внешней средой или с другими системами.
Единицей измерения как теплоты, так и работы - Дж. Внесистемная единица – калория. (1 кал = 4,1868 Дж).
В термодинамике принята следующая система знаков:
q < 0 - теплота выделяется системой,
q > 0 - теплота поглощается системой,
DU> 0 - внутренняя энергия системы увеличивается,
DU< 0 - внутренняя энергия системы уменьшается,
А>0 – работа совершается системой, работа расширения (DV>0),
A<0 – совершается над системой, работа сжатия (DV<0).
1.3. ПЕРВОЕ НАЧАЛО (закон) ТЕРМОДИНАМИКИ
Первый закон термодинамики – это фактически закон сохранения и превращения энергии.
Существует несколько формулировок:
Date: 2015-05-09; view: 712; Нарушение авторских прав