
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энтропия в замкнутых системах. Обратимость процессов как условие сохранения энтропии. Энтропия и необратимость. Неравенство Клаузиуса
|
|
Для пояснения связи энтропии с неполной преобразуемостью теплоты в работу обратимся снова к циклу Карно, используя целесообразную в данном случае дифференциальную форму записи. Поскольку никаких потерь в машине Карно нет, то полученную за цикл от машины работу можно представить как разность теплоты, полученной рабочим телом от нагревателя, и теплоты, отданной рабочим телом холодильнику, то есть dA = dQн - dQх. Теперь воспользуемся выражением для коэффициента полезного действия машины Карно (4.1) h = dA/dQн = 1 - dQх/dQн = 1 - Тх/Тн. Откуда dQх/dQн = Тх/Тн. При передаче теплоты рабочему телу в изотермическом процессе равны температуры нагревателя и рабочего тела Тн = Трт и, соответственно, равны отданная нагревателем теплота и теплота, полученная рабочим телом, dQн = dQрт. Теперь, используя выражение (5.1) для изменения энтропии, мы можем представить принципиально не преобразуемую в работу за цикл теплоту выражением
dQх = Тх (dQн / Тн) = Тх (dQрт / Трт) = ТхdS,
из которого видно, что количество принципиально не преобразуемой в работу за цикл теплоты зависит от температуры холодильника тепловой машины и изменения в рабочем цикле энтропии рабочего тела, а именно равно их произведению. Здесь речь идет о том количестве энтропии, которое забирается рабочим телом у нагревателя и отдается холодильнику, и при этом понижается степень хаотичности состояния нагревателя, но в равной мере повышается степень хаотичности холодильника, а в целом хаотичность состояния всей системы остается неизменной. Поскольку каждый из сомножителей в правой части равенства в замкнутой системе не может быть равен нулю, то невозможно за цикл не отдавать часть теплоты холодильнику (утрачивая после этого возможность ее дальнейшего преобразования в работу).
Уравнение (5.1) показывает, что в теплоизолированной (δQ = 0) термодинамической системе энтропия может сохраняться, но это условие (отсутствие теплообмена с внешним миром) является лишь необходимым, но не достаточным для сохранения энтропии.
Опыт показывает, что в изолированных системах даже при отсутствии теплообмена энтропия может возрастать, если в них идут релаксационные процессы самопроизвольного выравнивания термодинамических параметров. Для возвращения системы в первоначальное состояние теперь необходимо внешнее воздействие – систему можно квазистатическим образом перевести в начальное состояние, используя отвод теплоты и вычисляя необходимое уменьшение энтропии согласно уравнению (5.1).
Спонтанные (самопроизвольные) изменения в адиабатически замкнутой (теплоизолированной) системе всегда ведут к возрастанию энтропии. В этой асимметрии течения природных процессов заключена причина различимости прошлого и будущего.
С течением релаксационных процессов в системе постепенно утрачивается возможность преобразования теплоты в работу, которая раньше существовала в силу наличия перепадов (неравномерности по объему) интенсивных параметров, например, при выравнивании температур нагревателя и холодильника у тепловой машины. Происходит также так называемая диссипация (рассеяние) энергии за счет работы сил трения, то есть превращение энергии макроскопических движений тел в энергию хаотического движения микрочастиц. Это означает, что самопроизвольно степень хаотичности состояния системы может только увеличиваться, но никогда не убывает, оставаясь неизменной в замкнутых системах лишь в случае протекания в них полностью обратимых процессов.
В необратимых процессах проявляется еще одно свойство энтропии, не связанное прямо с введением понятия энтропии, для чего было вполне достаточно рассмотрения полностью обратимых процессов (пусть даже в идеализированных экспериментах).
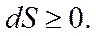 |
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ иногда формулируют как принцип неубывания энтропии при любых процессах, идущих в замкнутых системах, и записывают математически как (5.5)
Таким образом, второе начало термодинамики несет в себе двойное содержание.
Во-первых, принцип существования и сохранения энтропии, утверждающий существование функции состояния, характеризующей степень хаотичности состояния термодинамической системы, и сохранение этой функции в замкнутых системах, при условии протекания в них полностью обратимых процессов. Принцип сохранения энтропии означает невозможность никаким способом понизить энтропию в полностью изолированных термодинамических системах.
Во-вторых, принцип самопроизвольного возрастания энтропии в замкнутых системах при протекании в них необратимых процессов. Это значит, что степень хаотичности изолированной термодинамической системы, находящейся в неравновесном состоянии, самопроизвольно возрастает до тех пор, пока в системе не установится термодинамическое равновесие. При этом энтропия системы стремится к максимуму.
В тех случаях, когда энтропия возрастает не только за счет поступления в систему теплоты извне, но и за счет спонтанно (самопроизвольно) идущих релаксационных процессов, термодинамическое тождество превращается в неравенство Клаузиуса. В общей форме оно записывается в виде
TdS > dU + dA. (5.6)
Запишем его в форме, связанной с газообразным состоянием,
TdS > dU + PdV. (5.7)
Это неравенство играет большую роль при рассмотрении процессов приближения термодинамических систем к равновесию в случаях, когда система открыта, то есть, не изолирована от внешнего мира. Наше знание того, что при приближении системы к равновесию энтропия стремится к максимуму, позволяет через неравенство Клаузиуса найти функции (разные для разных случаев открытости), которые при приближении открытых систем к равновесию стремятся к своему экстремуму (минимуму). Этими функциями (аналогами потенциальной энергии для разных типов термодинамических процессов) являются: внутренняя энергия, энтальпия, свободная энергия и термодинамический потенциал Гиббса. Подробнее об этих функциях будет рассказано в следующей главе.
6. ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
Date: 2015-05-09; view: 1462; Нарушение авторских прав