
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Спектр атома водорода по Бору. Постулаты Бора позволили рассчитать спектр атома водорода и водородоподобных систем – систем, состоящих из ядра с зарядом Z∙e и одного электрона
|
|
Постулаты Бора позволили рассчитать спектр атома водорода и водородоподобных систем – систем, состоящих из ядра с зарядом Z∙e и одного электрона (например, ионы Не+), а также теоретически вычислить постоянную Ридберга.
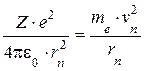 - уравнение предложенное Резерфордом;
- уравнение предложенное Резерфордом;
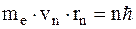 - первый постулат Бора.
- первый постулат Бора.
Решая эту систему уравнений, можно получить:
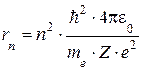 (5.2)
(5.2)
Для атома водорода (Z = 1) радиус первой орбиты электрона при n = 1, называемый первым Боровским радиусом:
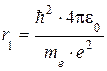 = 0,528∙10-10м.
= 0,528∙10-10м.
Т.к радиусы стационарных орбит измерить невозможно, то для проверки теории надо обратиться к величинам, которые могут быть измерены экспериментально, например, к энергии, излучаемой и поглощаемой атомами водорода.
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии и потенциальной энергии в электростатическом поле ядра:
Е = 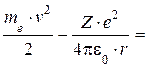
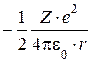 (5.3)
(5.3)
(т.к. из уравнения Резерфорда следует, что 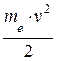 =
= 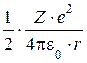 )
)
Учитывая квантованные значения rn, получим, что энергия электрона может принимать только дискретные значения:
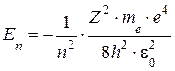 , (5.4)
, (5.4)
 где n = 1,2,3…- главное квантовое число, определяющее энергетические уровни атома. (Энергетическое состояние с n = 1 – основное или нормальное, начиная с n > 1 – возбуждённое.)
где n = 1,2,3…- главное квантовое число, определяющее энергетические уровни атома. (Энергетическое состояние с n = 1 – основное или нормальное, начиная с n > 1 – возбуждённое.)
Знак «-» означает, что электрон находится в связанном состоянии.
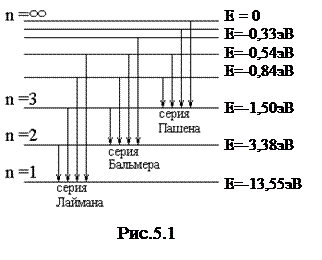
Придавая n различные целочисленные значения, получим для атома водорода (Z = 1) по формуле (5.4) энергетические уровни (см. рис.5.1)
Атом водорода обладает минимальной энергией (Е1 = -13,55эВ) при n = 1 и максимальной энергией (Еmax = 0) при n = ∞ (при удалении электрона из атома).
Подставляя в обобщённую формулу Бальмера k =1 и n = 2,3,4…, получаем группу линий – серию Лаймана, соответствующих переходам электронов с возбуждённых уровней (n = 2,3,4…) на основной (k =1). Аналогично, при подстановке k = 2,3,4,5,6 и соответствующих им значений n, получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри (на рис.5.1 представлена только часть из них).
Теория Бора была важным этапом в создании квантовой механики. Но серьёзным её недостатком была невозможность описания с её помощью спектра атома гелия – одного из простейших, следующего за водородом. Теория не смогла объяснить интенсивности спектральных линий и ответить на вопрос: почему совершаются те или иные переходы.
Date: 2015-05-08; view: 829; Нарушение авторских прав