
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электролитическая диссоциация и водородный показатель среды (рН)
|
|
Рекомендуемая литература по теме 5.1 приведена на с. 41.
Электролитическая диссоциация – это обратимый процесс распада молекул на ионы под действием полярных молекул растворителя.
Электролиты – это вещества, которые в растворах и в расплавах распадаются на ионы, поэтому их растворы и расплавы проводят электрический ток.
Неэлектролиты существуют в растворах в виде молекул и не проводят электрический ток.
К электролитам относятся кислоты, основания и многие соли. Диссоциации подвергаются вещества, в молекулах которых имеется ионная или ковалентная полярная связь, например:
а) кристаллы КСl в воде:
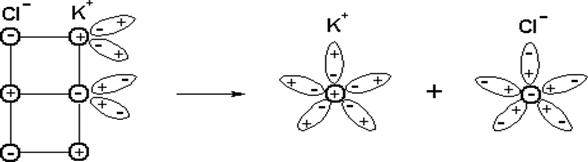
гидратированный гидратированные ионы К+ и С1-
фрагмент ионной
кристаллической
решетки
б) полярные молекулы HCl в воде:
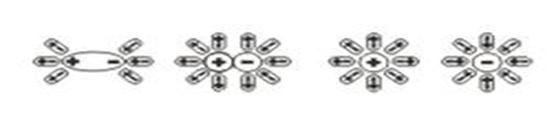
Основной причиной электролитической диссоциации является гидратация (в общем случае – сольватация) исходных кристаллов или молекул и образующихся ионов молекулами полярного растворителя. Количественной характеристикой процесса диссоциации является степень диссоциации (α).
Степень диссоциации – это отношение числа распавшихся на ионы молекул растворенного вещества (n) к общему числу молекул в растворе (N): α =n/N, выражается в долях единицы или в процентах. На степень диссоциации оказывают влияние природа растворителя и растворенного вещества, концентрация, температура, величина заряда ионов. Чем больше разбавление раствора, тем выше степень диссоциации электролита в нем.
В зависимости от степени диссоциации все электролиты делятся на сильные (α > 30 %), слабые (α < 3 %), а также электролиты средней силы
(3 % < α < 30 %) (см. прил. А, табл. А.3).
Величина степени диссоциации может служить для сравнения силы электролитов только при одинаковых концентрациях. Для слабых и средних по силе электролитов чаще пользуются величиной, не зависящей от концентрации, которая называется константой диссоциации (КД). Это фактически константа равновесия обратимой реакции электролитической диссоциации.
Константа диссоциации – это отношение произведения концентраций ионов, образовавшихся в результате электролитической диссоциации, к концентрации недиссоциированных молекул, взятых в степени их стехиометрических коэффициентов:
КА  К+ + А−;
К+ + А−;
КД = [К+]∙[ А−]/[КА].
Константа электролитической диссоциации зависит от природы растворителя и температуры.
Date: 2015-05-08; view: 977; Нарушение авторских прав