
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Розрахунки констант хімічної рівноваги
|
|
В теоретичних розрахунках і на практиці звичайно визначають як константи рівноваги за стандартних умов (Т = 298 К і Р = 1,013×105 Па), так і константи рівноваги при будь-якій температурі.
Константу рівноваги при 298 К (Кр,298) можна визначити, виходячи з рівняння ізотерми реакції Вант-Гоффа
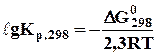 . (6.11)
. (6.11)
Можна визначити Кр,298 і шляхом алгебраїчного підсумовування допоміжних реакцій, стандартні константи рівноваги яких відомі (докладно цей метод для визначення 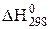 описаний на стор. 26). У даному випадку правило визначення константи рівноваги має вигляд:
описаний на стор. 26). У даному випадку правило визначення константи рівноваги має вигляд:
якщо Х = ±mI ±nII ± … ± iI; (6.12)
то 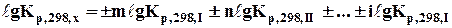 , (6.13)
, (6.13)
де Х – базове рівняння, для якого треба визначити Кр,298,х; І. ІІ, …, І – допоміжні реакції, стандартні константи рівноваги яких (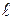 gКр,298,І і т.д.) відомі; m, n, …, i –коефіцієнти при допоміжних реакціях.
gКр,298,І і т.д.) відомі; m, n, …, i –коефіцієнти при допоміжних реакціях.
Визначення констант рівноваги реакцій при будь-якій температурі засновано на застосуванні рівнянь ізотерми реакції Вант-Гоффа і Гіббса-Гельмгольца у вигляді:
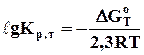 ; (6.14)
; (6.14)
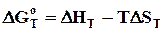 . (6.15)
. (6.15)
При визначенні DНТ і DSТ можна скористатись емпіричним температурним рядом теплоємкості (3.8; 4.9). У цьому випадку дістанемо рівняння Тьомкіна-Шварцмана
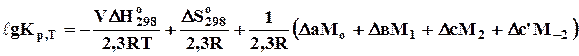 . (6.16)
. (6.16)
Якщо визначати DНТ і DSТ за допомогою функцій тепловмісту і приведеної енергії Гіббса (3.9; 4.10), одержимо рівняння
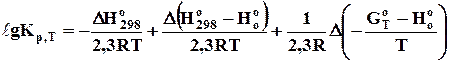 . (6.17)
. (6.17)
Можна розрахувати константу рівноваги прямим методом за рівняннями (6.1; 6.2), визначивши експериментально рівноважні концентрації (парціальні тиски) реагуючих речовин.
Задача 6.1. Феромарганець (сплав марганцю з залізом) в промислових умовах одержують шляхом відновлення залізної руди і оксиду марганцю (IV) коксом (вуглецем) за реакцією
Х. Fe2O3 + MnO2 + 5C = 2Fe + Mn + 5CO.
Визначити константи рівноваги реакції при 298 і 1000 К і зробити висновки що до умов проведення реакції.
Розв'язання. Константу рівноваги при 298 К визначимо за рівнянням (6.13), підібравши з табл. Д.3 допоміжні реакції, Кр,298 яких відомі:
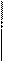 I. Fe2O3 + 3CO = 2Fe + 3CO2 +1
I. Fe2O3 + 3CO = 2Fe + 3CO2 +1 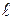 gKp,298,I = 5,50;
gKp,298,I = 5,50;
II. MnO2 + 2C = Mn + 2CO +1 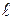 gKp,298,II = -33,77;
gKp,298,II = -33,77;
III. 2CO = C + CO2 -3 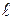 gKp,298,III = 21,02.
gKp,298,III = 21,02.
Для реакцій І і ІІ індикатори (підкреслені), коефіцієнти і знаки підбираємо як звичайно (стор. 26). Оскільки для третьої реакції підібрати індикатор неможливо, то знак і коефіцієнт для неї підбирають таким чином, щоб можна було при підсумовуванні реакцій скоротити речовину, що не входить в рівняння Х (СО2). Зваживши на кількість моль СО2 в рівнянні І(3) і на коефіцієнт при рівнянні (+1), вибираємо для третьої реакції коефіцієнт (-3).
Перевірку проводимо за рівнянням (6.12) – позитивна. Константа рівноваги при 298 К має значення:
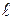 gКр,298,х =
gКр,298,х = 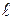 gКр,298,І +
gКр,298,І + 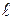 gКр,298,ІІ -3
gКр,298,ІІ -3 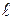 gКр,298,ІІІ =
gКр,298,ІІІ =
= 5,50 + (-33,77) - 3×21,02 = -90,77;
КР,298,х = 1,7×10-91.
Видно, що константа рівноваги при 298 К дуже мала величина і реакція за цих умов зміщена ліворуч на 100%. Одержати при 298 феромарганець не можна.
Визначимо якісний вплив температури на константу рівноваги реакції (Х). З цією метою обчислимо тепловий ефект реакції за рівнянням (3.2)
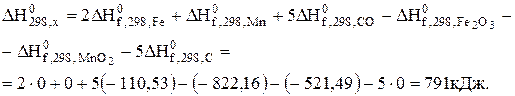
Оскільки DН > 0, то виходячи з рівняння ізобари (7.12), можна сподіватись, що при підвищенні температури константа рівноваги зростатиме. Визначимо константу рівноваги при 1000 К за рівнянням Тьомкіна-Шварцмана (6.16):
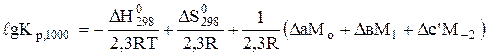 ;
;
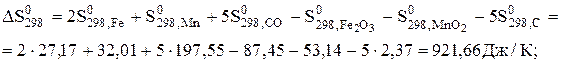
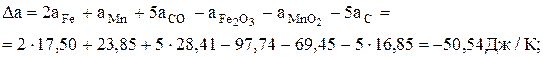
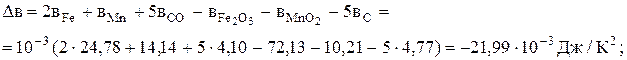
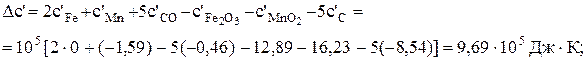
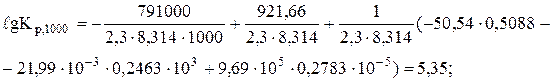
Кр,1000 = 2,2×105.
Таким чином, реакція одержання феромарганцю вже при 1000 К протікає в прямому напрямку на 100%.
Задача 6.2. В промисловості хром добувають відновленням оксиду хрому (ІІІ) алюмінієм за реакцією
Cr2O3 + 2Al = 2Cr + Al2O3.
Визначити константи рівноваги реакції при 298 і 1000 К, якщо відомі зміна тепловмісту реакції при 298 К (4,52 кДж) і зміна приведеної енергії Гіббса при 1000 К (-26,29 Дж/К).
Розв'язання. Константу рівноваги реакції при 298 К визначимо за рівнянням Вант-Гоффа (6.11):
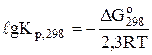 .
.
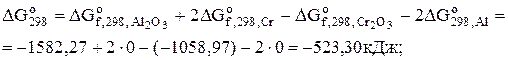
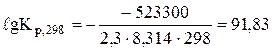 ;
;
Кр,298 = 6,8×1091.
Константу рівноваги при 1000 К знайдемо за рівнянням (6.17)
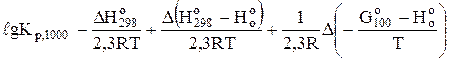 ;
;

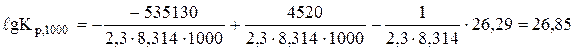 ;
;
Кр,1000 = 7,1×1026.
Таким чином, реакція відновлення з оксиду хрому алюмінієм проходить самодовільно на 100% і при 298 і при 1000 К. При зростанні температури значення константи рівноваги зменшується, що відповідає рівнянню ізобари, бо DН < 0. В промисловості реакцію проводять при високих температурах, бо при низьких - швидкість реакції мала.
Date: 2015-05-08; view: 935; Нарушение авторских прав