
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Коллондты ерітінділерді химиялық жолмен алуга мысалдар
|
|
1 -мысал. 1,7% күміс нитратының ерітіндісін 100 мл-дей суға оншақты тамшысын тамызады. Мұнан соң, ерітіндіні шайқап аралыстыра отырып, 1,7% иодты калийдің 1 мл ерітіндісін қосады. Ауа көк жалтылдаған иодты күміс зольі түзіледі.
Химия тілінде жазалық:
AgNO3 + KJ = AgJ↓ + KNO3
Стехиометрия бойынша иодты калий артық алынып тұр.
Демек, KJ ↔ K+ + J-
Панет-Фаянс ережесі бойынша иодты күміске иодид иондар тартылады да, мицелласының формуласы төмендегі түрде жазылады:
{(AgJ)m· nJ- (n – x)K+}- xK+
2 - мысал. Кальций гидроксиді қаныққан ерітіндісін ұзақ уақыт ауада сақтау барысында ерітінді беті лайқаланады. Аталған құбылысты түсіндір.
Шешімі: Ауа құрамындағы көмір қышқыл газы гидроксидпен әрекеттесіп, нашар еритін карбонат түзеді.
Са(ОН)2 + СО2 = СаСО3 + Н2О
Түзілген кальций карбонаты агрегат болып табылады. Ерітіндідегі кальций иондарын бойына тартады да, жүйеде коллоидты ерітінді түзіліп, оның түсі лайқа тартады. Коллоидты ерітіндінің мицелласы:
{(CaCO3) · nСа2+ • 2(n-х) ОН-}٭ 2хОН-
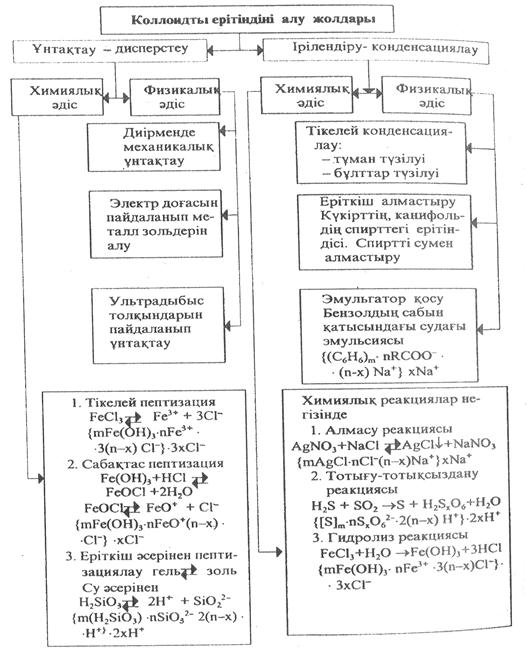
3- мысал. Хлорлы мыс ерітіндісімен натрий сульфидінің ерітіндісі берілген. Оң зарядты коллоидты бөлшек түзілу үшін ерітінділердің қайсысын бірінші етіп қосу керек.
Шешімі: Екі ерітіндінің де концентрациясы бірдей деп қабылдалық. Түсінікті болу үшін СuСl2-ні Na2S-ке қосалық.
СuС12 + Na2S = СuS↓ + 2NаС1
Хлорлы мыс ерітіндісін толық қосып біткен жоқпыз. Демек, жүйеде артық электролит Na2S. Панет-Фаянс ережесі бойынша сульфид аниондары агрегат мыс сульфидіне тартылуы тиіс, яғни:
(СuS)m + nS2- = (Сus)m · nS2-
Бұл жағдайда потенциал анықтауыш ион теріс зарядты, яғни коллоидты бөлшек заряды да теріс болады деген сөз. Есеп шарты бойынша оң зарядты коллоидты бөлшек алынуы қажет. Олай болса, керісінше натрий сульфидін хлорлы мыс ерітіндісіне жайлап қосамыз. Бұл орайда хлорлы мыс мөлшері артық болады да, потенциал анықтауыш ион мыс ионы болып табылады. Коллоидты бөлшек оң зарядқа ие болады. Мицелла формуласы:
{(СuS)m·nСu2+·2(n-х)Сl-} ٭·2хСl-
4- мысал. Тұз қышқылын пептизатор ретінде пайдалана отырып, қалайы қышқылының коллоидты ерітіндісін төрт хлорлы калайыдан алыңыз.
Шешімі: Ең бірінші кезекте төрт хлорлы қалайы қосылысын гидролизге ұшыратып, қалайы қышқылын тұнбаға түсіреміз, яғни
SnCl4 + H2O = 4HCl + Sn(OH)4
Sn(OH)4 → H2SnO3 + H2O
Түзілген тұнбаға тұз қышқылын тамызсақ, сабақтас пептизация байыбымен қалайы қышқылының коллоидты ерітіндісі түзіледі.
H2SnO3 + HCl = SnOCl2 + 2H2O
SnOCl2 ↔ SnO2+ + 2Cl-
SnO2+ иондары қалайы қышқылына адсорбцияланып заряд береді де, оны ерітіндіге көшіреді. Коллоидты бөлшек мицелласы:
{(H2SnO3)m · nSnO2+· 2(n – x)Cl- · 2xCl-
Егер, пептизатор ретінде натрий гидроксидінің ерітіндісі пайдаланылса, онда коллоидты бөлшек теріс зарядқа ие болады.
H2SnO3 + NaOH = Na2SnO3 + 2H2O
Na2SnO3 = 2Na+ + SnO32-
{(H2SnO3)m · nSnO2- · 2(n – x)Na+}2x- · 2xNa+
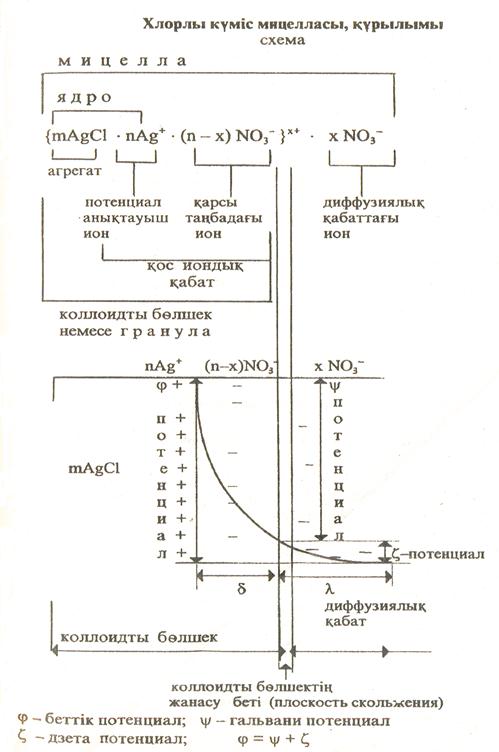
4.4.4. Коллоидты ерітіндідегі дисперсті фаза құрылымы. Коллоидты ерітінділердің кәдімгі ерітінділерден басты айырмашылығы, онда еріген зат бөлшектерінің ірі болып келуі дейді. Ерітілген зат бөлшектері коллоидты ерітінді құрамында мицелла түрінде ұшырасады. Жалпы коллоидты ерітінді құрамында бөлшектер құрылымын оларды химиялық конденсация жолымен алу барысында әңгімеледік. Есімізге түсіру үшін хлорлы күмістің судағы зольін қарастыралық.
1.Күміс нитраты артық алынған жағдайдағы бөлшек құрылымы:
{mAgCl · nAg+ · (n – x)NO3- }xNO3-
2.Ас тұзының мөлщері артық алынған жағдайдағы бөлшек құрылымы:
{mAgCl · nCl- (n – x)Na+ } xNa+
Мұндағы: mAgCl – агрегат деп аталынады. Кейбір оқулықтарда mAgCl ядро деп те аталынады.mAgCl · nAg+ немесе mAgCl · nCl- коллоидты ерітінді өлшегінің ядросын құрайды.
Агрегатқа тартылған иондар потенциал анықтауыш иондар деп аталады да ядроға φ –ге тең потенциал береді.
Потенциал анықтауыш ионға қарсы таңбаға қос иондық қабат түзуге тартылған иондар – қарсы таңбадағы иондар (противоионы) деп аталады. Қарастырылып отырған бірінші жағдай үшін қарсы таңбадағы иондар NO3-, ал екінші жағдайда Na+.
Потенциал анықтауыш иондар мен қарсы таңбадағы иондар коллоидты бөлшектің қос иондық қабатын құрайды. Ядро және қарсы таңбадағы иондар құрылымы коллоидты бөлшек немесе гранула деп аталады. Коллоидты бөлшек заряд потенциал анықтауыш ион зарядымен анықталады.
Қос иондық қабат бөлігінде қарсы таңбадағы иондар саны потенциал анықтауыш иондар санынан кем болады. Қарсы таңбадағы иондардың жетіспейтін шамасы қос иондық қабаттың сыртында орналасқан диффузиялық қабатта болады.
Қос иондық қабаттың қалыңдығы «δ», ал диффузиялық қабат қалыңдығы «λ» деп белгіленеді.
Диффузиялық ион қабатының қалыңдығы төмендегі формула бойынша есептелінеді:
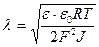
Мұндағы: ε – диэлектрлік өтімділігі;
ε 0 – 8,85 ·10-12 ф/м – электірлік тұрақты шама;
R,T – универсалды газ тұрақтысы және температура;
F – Фарадей саны, 96500 кулон; J – ерітіндінің иондық күші.
Коллоидты бөлшек және диффузиялық қабаттағы иондар коллоидты ерітіндінің мицелласын құрайды. Мицелла электр бейтарап бөлшек.
Коллоидты бөлшектің қос иондық қабатындағы қарама-қарсы иондарға қарағанда потенциал анықтауыш иондары артығы дзета потенциал немесе электростатикалық потенциал шамасын білдіреді.
Демек, дзета потенциал коллоидты бөлшек пен диффузиялық ион қабаты арасында туындайды. Дзета потенциал ξ – таңбасымен белгіленіп, оң да теріс те мәндерге ие бола береді. Коллоидты бөлшектің қос иондық қабатында потенциал анықтауыш иондар саны мен қарама-қарсы таңбадағы иондар саны тең болса, дзета потенциал мәні нольге айналып, оны - изоэлектрлік күй-деп атайды. Мицелла құрылымы хлорлы күміс зольі негізінде - схема түрінде келтірілген.
1 - мысал. Барий сульфатының коллоидты ерітіндісі алынды. Коллоидты ерітіндідегі электролит - ас тұзының концентрациясы 25 мг/л. Ерітіндінің диэлектрлік өтімділік шамасы 82,2, ал темпсратурасы 288К. Диффузиялық қабаттың қалыңдығы қандай?
Талдау. Барий сульфатының коллоидты ерітіндісінің мицелласы:
{mВаSО4 • nВа2+ • 2(n-х) С1-} 2хС1
-
Диффузиялық қабаттың қалыңдығын анықтайтын формуланы еске түсіреміз:
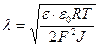
Ерітіндінің иондық күші Льюис-Рэндалл формуласы бойынша есептеледі, яғни: J = 1 / 2  CiZi2 Енді есептің берілтенін жазып алып, диффузиялық қабат қалыңдығын есептеуге болады.
CiZi2 Енді есептің берілтенін жазып алып, диффузиялық қабат қалыңдығын есептеуге болады.
Date: 2015-05-08; view: 2393; Нарушение авторских прав