
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Сұйық – газ жанасу шегіндегі адсорбция
|
|
(1) теңдеуден беттегі бос энергияның өлшемі бірліктегі беттік керілу күші өлшемімен бірдей екені байқалады. Ал беттік керілу күші деп сұйық бетін шектейтін сызықтың бірлік өлшеміндегі ауданға әсер етуші күшті айтады. Әдетте беттік құбылыстарды талқылағанда беттегі бос беттік энергия деп айтпайды, тек ғана беттік керілу дейді. Мұның басты себебі беттік керілу деген ұғым сұйық-газ немесе сұйық-сұйық сияқты жүйелердегі жанасу шегінде жиі кездеседі және оның мәнін тікелей өлшеп табуға болады.
Таза сұйықтардың беткі қабатының құрамы оның бүкіл көлеміндегі құраммен бірдей болады. Сондықтан да еріткіште кез келген затты еріткенде үш түрлі жай болуы мүмкін: берілген заттың еріткіште еруі оның беттік керілісін өзгертпейді; берілген заттың еріткіште еруі еріткіштің беттік керілуін жоғарылатады; берілген заттың еріткіште еруі оның беттік керілуін төмендетеді.
Термодинамиканың екінші заңына сәйкес беттік энергия өзінің ең кіші мәніне ұмтылатындықтан, берілген зат еріткіштің беттік керілуін төмендетсе, оның беткі қабатындағы еріген заттың концентрациясы ерітіндінің көлеміндегіден артық болуы керек. Ал еріткіштің беттік керілісін арттыратын болса, онда ерітіндінің беткі қабатындағы еріген заттың концентрациясы ерітінді көлеміндегіден кем болуы керек. Олай болса, сұйық-газ жанасу шегінде еріген зат концентрациясы өзгереді, яғни адсорбция құбылысы байқалады.
Сұйық-газ жанасу шегіндегі адсорбцияны қатты дене-газ жанасу шегіндегі адсорбция процесімен салыстырсақ, ол өзіне тән кейбір сипаттамаларымен ерекшеленеді екен. Біріншіден, сұйық бетіндегі бөліктердің бірдей немесе бір сипатта болуы адсорбтив молекулаларының белгілі бір бөліктерге бағытталуын, жиірек шоғырлануын болдырмайды. Екіншіден, адсорбтив молекулаларының сұйықтағы беткі қабатта емін-еркін жылжып, жылулық қозғалыста болуға мүмкіндігі бар. Сол сияқты қатты адсорбенттің беткі қабатын анықтаудан сұйықтың адсорбциялайтын беткі қабатының ауданын (S) дәл есептеп, өлшеу жеңіл. Сұйық-газ жанасу шегіндегі адсорбция процесінің тағы да бір ерекшелігі, ол адсорбция құбылысы жүріп жатқан сәттегі беттік әнергиның өзгеруін тікелей өлшеп табу мүмкіндігінің болатындығы.
Барлық еритін заттар өздерінің сұйық-газ жанасу шегіндегі адсорбциялану қабілетіне қарай екі топқа бөлінеді: беттік активті заттар; беттік активсіз заттар. Енді олардың әрқайсысына жеке тоқталайық.
Беттік активті заттардың (БАЗ) беттік керілуі еріткіштікінен аз болуы керек. Олардың ерігіштік қабілеті нашар болады және де жеке молекулалық өте жұқа адсорбциялық қабат пайда болатындықтан, ол адсорбент бетінің қасиеттерін күрт өзгертеді. Сондай-ақ БАЗ-дар өздерінің физикалық және химиялық қасиеттеріне орай үш топқа бөлінеді: молекулалық, анион активті; катион активті. Молекулалық БАЗ-ды ионогенсіз, ал қалған екеуін ионогенді дейді.
Спирт молекулалары, органикалық карбон қышқылдары, күрделі белокты қосылыстар мен басқа да заттар молекулалық немесе ионогенсіз БАЗ тобына жатады. Ионогенді анион активті БАЗ суда ерігенде иондарға диссоциацияланады және ондағы беттік активтіліктітек анион ғана көрсетеді. Оларға мысал ретінде сабын, сульфоқышқылдар және олардың тұздарын, басқа да қосылыстарды келтіруге болады. Ионогенді катион активті БАЗ суда еріген кезде иондарға ыдырайды, бірақ бұл ерітінділерде беттік активтілік тек катиондарда ғана болады. Оларға құрамында азоты бар органикалық негіздер мен олардың тұздары жатады.
Барлық БАЗ ортақ сипаттардың бірі – олардың молекулаларының полюсті және полюссіз екі бөлшектен тұратыны. Полюсті топқа ОН, СООН, NH2 сияқты гидрофильді, ал полюссізге көмірсутекті немесе ароматты радикалдар жатады. Полюсті бөлшектерде едәуір мәндегі дипольдік момент болады және олар жақсы гидраттанады, яғни әлсіз болса да сумен әрекеттеседі. Әлбетте полюсті топ БАЗ-дың суға жақындығын анықтацды. Полюсті топтағыдан, полюссіз бөлшекке енетін көмірсутекті радикалдар гидрофобты, яғни ол сумен әрекеттесе де, араласа да бермейтіндіктен, судағы БАЗ ерігіштігін төмендетеді.
Шартты түрде БАЗ молекуласының полюсті немесе гидрофильді бөлігін дөңгелекшемен, ал оның полюссіз немесе гидрофобты бөлігін таяқшамен белгілейді. Енді осындай молекуланы суда ерітсе, онда БАЗ молекуласы сумен әрекеттескенде оның полюсті бөлігі су ішіне ұмтыла орналасса, ал оның полюссіз немесе бөлігі өзін судың сыртында болады. Мұндайда судың беткі қабатын шексіз үлкейді деп көз алдымызға елестетсек, полюсті бөлігі судың бетінде тік орналасады. Олай болса, судың полюссіз бөлшекті сыртқа итеру күшінің әсерінен су беті осы гидрофобты топпен қанығады. Осы бағытта жүргізілген көптеген тәжірибелер көрсетіп отырғандай, БАЗ радикал құрамына енетін көмірсутекті тізбектің ұзындығы артқан сайын, оның судағы ерігіштігі нашарлай түсіп, оның басым көпшілігі сұйық бетіне орналасады. Мұның салдарынан олардың адсорбциялау қабілеті артады. Ендеше гидрофобты топтың сұйық бетіне молырақ жиналғандығынан да оның беттік керілуі азаяды. Сондықтан да заттардың беттік активтілігі және соған орай адсорбциялау қабілеті полюсті топтың табиғатына, молекула құрылысы мен көмірсутекті тізбектің ұзындығына тәуелді болады екен. Бұл пікірді дәйекті дәлелдеу мақсатымен жүргізілген зерттеулерге қарағанда, қосылыс құрамына енетін көмірсутекті тізбек ұзындығы артқан сайын (мысалы, органикалық карбон қышқылдарын алса), олардың судағы ерігіштігі нашарлай береді. Қаныққан карбон қышқылдарының судағы ерітінділерін зерттегенде, қышқыл құрамындағы көмірсутекті тізбек әрбір – СН2 – тобына көбейген сайын, олардың адсорбциялау қабілеті шамамен 2-3 есе артады екен. Бұл Траубе-Дюкло ережесі деп аталады: карбон қышқылындағы тізбек ұзындығы арифметикалық прогрессиямен өссе, ал олардың беттік активтілігі геометриялық прогрессиямен артады.
Траубе-Дюкло ережесі тек аса сұйық, төменгі концентрациядағы ерітінділер үшін ғана қолданады.
Беттік активсіз заттардың ерекшелігі мен сипаты еріткішпен салыстырғанда, беттік керілуі артық және жақсы ериді. Оларға барлық бейорганикалық электролиттер жатады: қышқылдар, негіздер, тұздар, құмырсқа қышқылы (НСООН), аминсірке қышқылы (H2NCH2COOH) сияқты кейбір органикалық қосылыстар. Ендеше беттік активсіз заттар суда ерігенде, судың беттік керілуін жоғарылатады, өйткені олар өзінің полюсті бөлігімен судың ішкі жағына ортасына ұмтылады да ерітінді бетіндегі концентрация төмендейді.
Сондай-ақ еріген кезде еріткіштің беттік керілуіне ешбір әсер етпейтін заттар да бар екенін айта кеткен жөн. Мұндай қосылыстардың қатарына қантты және қант тектес заттарды жатқызуға болады. Олардың сипатын жан-жақты зерттеу нәтижесінде осы заттардың молекулалары беткі қабат пен бүкіл көлем аралығында бір қалыпты таралатыны анықталды, мысалы қант молекуласы судың бүкіл көлемінде бірдей концентрациямен таралады екен.
Беттік керілу (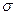 ), еріген заттың концентрациясы (С) және осы еріген заттың ерітіндінің беткі қабатындағы артық қоры (Г) арасындағы тәуелділікті өрнектейтін математикалық теңдеуді 1876 жылы америка ғалымы Дж. Гиббс тапқан:
), еріген заттың концентрациясы (С) және осы еріген заттың ерітіндінің беткі қабатындағы артық қоры (Г) арасындағы тәуелділікті өрнектейтін математикалық теңдеуді 1876 жылы америка ғалымы Дж. Гиббс тапқан:
Г = (- C/RT) ∙ (d 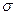 /dC) (30)
/dC) (30)
Мұндағы d 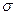 /dC – ерітіндідегі беттік керілудің концентрацияға тәуелді өзгеруі, R – универсал газ тұрақтысы, С – еріген заттың молярлі концентрациясы, Т – термодинамикалық немесе абсолюттік температура.
/dC – ерітіндідегі беттік керілудің концентрацияға тәуелді өзгеруі, R – универсал газ тұрақтысы, С – еріген заттың молярлі концентрациясы, Т – термодинамикалық немесе абсолюттік температура.
Теңдеудегі dσ/dС>0 болса, онда адсорбция оң болады, өйткені мұндай адсорбция кезінде беттік керілу азаяды. Еріген заттың концентрациясы артқан сайын, беттік керілу азаяды. Гиббс теңдеуінен байқалатындай, беттік активсіз заттарды еріткендегі концентрация өскен сайын, ерітіндінің беттік керілуі де артады, яғни мұндай жағдайдағы адсорбция теріс мәнде болады, өйткені беткі қабаттағы концентрация көлемдегіден аз. Олай болса, dσ/dС<0 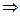 Г<0
Г<0
Ал, dσ/dС=0 болса, адсорбция жүрмейді (Г=0).
Б. И. Шишковский органикалық қаныққан карбон қышқылдарының судағы ерітінділерін жан-жақты зерттей келіп, беттік керілудің концентрацияға тәуелділігін математикалық тұрғыдан шешетін, тәжірибе кезінде табылған теңдеуді ұсынды:
 ∆σ = B ln (AС + 1)(31)
∆σ = B ln (AС + 1)(31)
мұндағы ∆σ- ерітінді мен еріткіштің беттік керулелерінің айырмасы; А және В – тәжірибе кезінде табылатын тұрақтылар; А - әрбір гомологиялық қатарға өзгергенде, Траубе-Дюкло ережесіне орай өзгеретін шама. Демек, гомологиялық қатар бір буынға (- СН2 -) артқанда, ол орташа есеп бойынша 3,2-ге тең, карбон қышқылдары үшін тәжірибе кезінде табылған тұрақты өлшем, С – концентрация.
Шишковский теңдеуін теорияға, тәжірибеге қайшы келмейтін жолмен де табуға болады екен. Ол үшін Ленгмюр (29) және Гиббс (30) теңдеулерін біріктіру қажет: Ленгмюрдің адсорбцияны сипаттайтын изотермасындағы Г мәнін Гиббс теңдеуіне қояды.
dσ/dC = –RТ (Г/C); dσ = –RТ Г 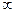 (dС/(С+B))
(dС/(С+B))
Және мұндағы соңғы өрнекті концентрация 0-ден С-ға дейінгі аралықта, яғни концентрацияның нөлге тең кезінен бастап, берілген концентрацияға дейінгідеинтегралдаса:
σ = σ0– RТ Г 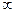 ln (С/B+1) (32)
ln (С/B+1) (32)
Енді бұл теңдеуді Шишковский теңдеуімен салыстырса σ = σ 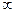 –B ln (AС+1), онда Шишковский теңдеуіндегі В- константаның мәнін қорытындылай келіп,
–B ln (AС+1), онда Шишковский теңдеуіндегі В- константаның мәнін қорытындылай келіп,
B = RТ Г 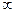 RТ/NА S0 (33)
RТ/NА S0 (33)
екенін жазуға болады.
Мұндағы NA – Авогадро саны; S0 – қаныққан қабаттағы бір молекула үлесіне тиетін аудан, В константасы Шишковский теңдеуіндегі шекті адсорбция мәнімен анықталады екен және оған осы кезде қаныққан адсорбциялық қабат немесе осы қаныққан адсорбциялық қабаттағы бір молекула үлесіне тиесілі аудан сәйкес болады. Ал Шишковский теңдеуіндегі А константасының мәні Ленгмюр теңдеуіндегі В константасымен мәндес.
БАЗ халық шаруашылығында кеңінен қолданылады. Олардың болмашы ғана мөлшерін басқа заттарға қосқанда, онымен жанасатын зат табиғаты өзгеріп, оның көптеген қасиеті, беттік сипаты өзгереді. Олай болса БАЗ пайдаланып, дисперстік жүйенің пайда болатын жағдайын ғана өзгертіп қоймастан, олардың тұрақтылығын да реттеуге болады. БАЗ қосқанда көптеген заттарды ұнтақтау процесі жақсарып, сұйықты ұсақтап шашу жұмыстарын әрі жеңілдетеді, әрі өзі де ұсақтайды. Сол сияқты кейбір жағдайларда БАЗ қосымша қосу арқылы қатты денелер үйкелісті қозғалыста болғанда, ондағы кедергіні азайтып, ұсақ бөлшектердің бір-біріне жабысқақтығын төмендетеді.
Кірленген бұйымдарды тазарту үшін БАЗ қатарына жататын сабын, түрлі жуғыш ұнтақтар қолданылады. Мұнда да әуелі беттік әсер арқылы БАЗ көбіктері керексіз кірді қоршап, оны кездемеден ажыратады.
Синтетикалық материалдарды өңдіргенде күйе, каолин сияқты активті толтырғыштар деп аталатын заттарды пайдаланады. Бұлар алынатын жаңа затқа үйкеліске төзімділік, беріктілік, қыздыру әсеріне қаттылық қасиеттер береді. Мұндайда түрлі толтырғыш ретінде қосылған БАЗ өзінің де, қосылған ортаның да бір сыпыра қасиетін жақсартумен қатар, олардың жалпы активтілігін де арттырады.
Date: 2015-05-08; view: 2536; Нарушение авторских прав