
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тройная точка. Диаграмма состояния
|
|
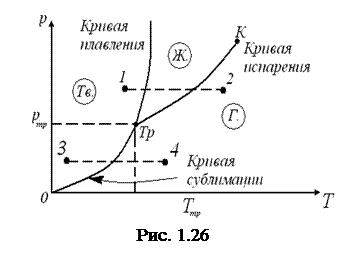 Возьмем вещество в виде жидкости и находящегося с ней в равновесии насыщенного пара и, не изменяя объема, станем отнимать от него тепло. Этот процесс будет сопровождаться понижением температуры вещества и соответствующим уменьшением давления. Поэтому точка, изображающая состояние вещества на диаграмме (р,Т), перемещается вниз по кривой испарения (рис.1.26). Это продолжается до тех пор, пока не будет достигнута температура кристаллизации вещества, отвечающая равновесному значению давления. Обозначим эту температуру Т тр. Все время, пока идет процесс кристаллизации, температура и давление остаются неизменными. Отводимое при этом тепло представляет собой тепло, выделяющееся при кристаллизации.
Возьмем вещество в виде жидкости и находящегося с ней в равновесии насыщенного пара и, не изменяя объема, станем отнимать от него тепло. Этот процесс будет сопровождаться понижением температуры вещества и соответствующим уменьшением давления. Поэтому точка, изображающая состояние вещества на диаграмме (р,Т), перемещается вниз по кривой испарения (рис.1.26). Это продолжается до тех пор, пока не будет достигнута температура кристаллизации вещества, отвечающая равновесному значению давления. Обозначим эту температуру Т тр. Все время, пока идет процесс кристаллизации, температура и давление остаются неизменными. Отводимое при этом тепло представляет собой тепло, выделяющееся при кристаллизации.
Температура Т тр и соответствующее ей равновесное давление р тр - единственные значения температуры и давления, при которых могут находиться в равновесии три фазы вещества: твердая, жидкая и газообразная. Соответствующая точка на диаграмме (р,Т) называется тройной точкой. Таким образом, тройная точка определяет условия, при которых могут находиться в равновесии одновременно три фазы вещества.
 По окончании процесса кристаллизации в равновесии будут находиться твердая и газообразная фазы. Если продолжать отнимать от вещества тепло, то температура снова начнет понижаться. Соответственно уменьшается давление паров, находящихся в равновесии с кристаллической фазой. Точка, изображающая состояние вещества, перемещается вниз по кривой сублимации.
По окончании процесса кристаллизации в равновесии будут находиться твердая и газообразная фазы. Если продолжать отнимать от вещества тепло, то температура снова начнет понижаться. Соответственно уменьшается давление паров, находящихся в равновесии с кристаллической фазой. Точка, изображающая состояние вещества, перемещается вниз по кривой сублимации.
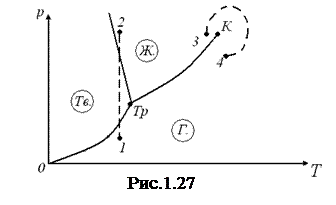
Температура тройной точки есть температура, при которой плавится вещество, находясь под давлением, равным р тр. При других давлениях температура плавления будет иной. Связь между давлением и температурой плавления изобразится кривой плавления, начинающейся в тройной точке. Таким образом, тройная точка оказывается лежащей на пересечении трех кривых, определяющих условия равновесия двух фаз: твердой и жидкой, жидкой и газообразной и, наконец, твердой и газообразной. В зависимости от соотношения между удельными объемами твердой и жидкой фаз кривая плавления идет либо так, как на рис. 1.26 (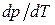 > 0), либо так, как на рис. 1.27 (
> 0), либо так, как на рис. 1.27 (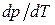 < 0).
< 0).
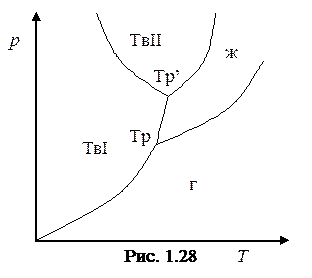 Кривые плавления, испарения и сублимации разбивают координатную плоскость на три области. Слева от кривых сублимации и плавления лежит область твердой фазы, между кривыми плавления и испарения заключена область жидких состояний, и, наконец, справа от кривых испарения и сублимации простирается область газообразных состояний вещества. Любая точка в одной из этих областей изображает соответствующее однофазное состояние вещества (все время имеются в виду только равновесные состояния, т. е. такие состояния, в которых вещество при неизменных внешних условиях пребывает сколь угодно долго). Всякая точка, лежащая на одной из разграничивающих области кривых, изображает состояние равновесия двух соответствующих фаз вещества. Тройная точка изображает состояние равновесия всех трех фаз. Таким образом, каждая точка на диаграмме изображает определенное равновесное состояние вещества. Поэтому ее называют диаграммой состояния.
Кривые плавления, испарения и сублимации разбивают координатную плоскость на три области. Слева от кривых сублимации и плавления лежит область твердой фазы, между кривыми плавления и испарения заключена область жидких состояний, и, наконец, справа от кривых испарения и сублимации простирается область газообразных состояний вещества. Любая точка в одной из этих областей изображает соответствующее однофазное состояние вещества (все время имеются в виду только равновесные состояния, т. е. такие состояния, в которых вещество при неизменных внешних условиях пребывает сколь угодно долго). Всякая точка, лежащая на одной из разграничивающих области кривых, изображает состояние равновесия двух соответствующих фаз вещества. Тройная точка изображает состояние равновесия всех трех фаз. Таким образом, каждая точка на диаграмме изображает определенное равновесное состояние вещества. Поэтому ее называют диаграммой состояния.
Для вещества с несколькими кристаллическими модификациями диаграмма состояния имеет более сложный характер. На рис.1.28 изображена диаграмма для случая, когда число различных кристаллических модификаций равно двум. В этом случае имеются две тройные точки. В точке Тр. в равновесии находятся жидкость, газ и первая кристаллическая модификация, в точке Тр' находятся в равновесии жидкость и обе кристаллические модификации.
Диаграмма состояния для каждого вещества строится на основе экспериментальных данных. Зная диаграмму состояния, можно предсказать, в каком состоянии будет находиться вещество при различных условиях (при различных значениях р и Т), а также какие превращения будет претерпевать вещество при различных процессах.
Поясним это следующими примерами. Если взять вещество в состоянии, соответствующем точке 1 на рис. 1.26, и подвергнуть его изобарическому нагреванию, то вещество будет проходить изображенную пунктирной прямой 1—2 последовательность состояний: кристаллы – жидкость - газ. Если то же вещество взять в состоянии, изображенном точкой 3, и также подвергнуть изобарическому нагреванию, то последовательность состояний (пунктирная прямая 3-4) будет иной: кристаллы превращаются непосредственно в газ, минуя жидкую фазу.
Из диаграммы состояния следует, что жидкая фаза может существовать в равновесном состоянии только при давлениях, не меньших чем давление тройной точки (то же самое относится и к твердой фазе II на рис. 1.28). При давлениях, меньших р тр, наблюдаются только переохлажденные жидкости.
У большинства обычных веществ тройная точка лежит значительно ниже атмосферного давления, вследствие чего переход этих веществ из твердого состояния в газообразное осуществляется через промежуточную жидкую фазу. Так, например, тройной точке воды соответствует давление 4,58 мм рт. ст. и температура 0,0075°С. Для углекислоты давление тройной точки равно 5,11 атм (температура тройной точки —56,6°С). Поэтому при атмосферном давлении углекислота может существовать только в твердом и газообразном состояниях. Твердая углекислота (сухой лед) превращается непосредственно в газ. Температура сублимации углекислоты при атмосферном давлении равна — 78°С.
Если удельный объем кристаллов превосходит удельный объем жидкой фазы, то поведение вещества при некоторых процессах может оказаться весьма своеобразным. Возьмем, например, подобное вещество в состоянии, изображенном точкой 1 на рис. 1.27, и подвергнем его изотермическому сжатию. При таком сжатии давление растет, и процесс изобразится на диаграмме вертикальной прямой (см. пунктирную прямую 1—2). В ходе процесса вещество проходит такую последовательность состояний: газ – кристаллы - жидкое состояние. Подобная последовательность, очевидно, наблюдается только при температурах меньших, чем температура тройной точки.
В заключение отметим еще одну особенность диаграммы состояния. Кривая испарения заканчивается в критической точке К. Поэтому возможен переход из области жидких состояний в область газообразных состояний, совершаемый в обход критической точки, без пересечения кривой испарения (см. изображенный пунктиром переход 3—4 на рис. 1.27). На рис. 1.13 показано, как выглядит такой переход на диаграмме (р,V). В этом случае переход из жидкого состояния в газообразное (и обратно) совершается непрерывно, через последовательность однофазных состояний. Отметим, что точке с координатой Т, взятой на кривой испарения, отвечает на рис. 1.13 весь горизонтальный участок соответствующей изотермы.
Непрерывный переход между жидким и газообразным состояниями возможен потому, что различие между ними носит скорее количественный, чем качественный характер. В частности, для веществ в любом из этих состояний отсутствует анизотропия. Непрерывный переход из кристаллического состояния в жидкое или газообразное невозможен, ибо характерной чертой кристаллического состояния, как мы знаем, является анизотропия. Переход же от состояния, обладающего анизотропией, к состоянию, ею не обладающему, может совершаться только скачком — анизотропия не может иметься только частично, она либо есть, либо ее нет, третья возможность исключена. По этой причине кривая сублимации и кривая плавления не могут обрываться подобно тому, как обрывается кривая испарения в критической точке. Кривая сублимации идет в точку р = 0 и Т = 0, кривая плавления уходит в бесконечность.
Точно так же невозможен непрерывный переход из одной кристаллической модификации в другую. Различные кристаллические модификации вещества отличаются присущими им элементами симметрии. Поскольку какой-либо элемент симметрии может только либо быть в наличии, либо отсутствовать, переход из одной твердой фазы в другую возможен только скачком. По этой причине кривая равновесия двух твердых фаз, подобно кривой плавления, уходит в бесконечность.
Date: 2015-05-05; view: 1326; Нарушение авторских прав