
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энтропия как функция состояния. Энтропия идеального газа
|
|
Величина S, определяемая соотношением 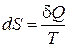 (только для обратимых процессов), называется энтропией системы. Это понятие было введено в термодинамику Клаузиусом в середине XIX века.
(только для обратимых процессов), называется энтропией системы. Это понятие было введено в термодинамику Клаузиусом в середине XIX века.
Несмотря на то, что изменение количества теплоты зависит от процесса, энтропия является функцией состояния. Для необратимых процессов будет выполняться неравенство: 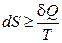 . Интегрируя обе части полученного выражения получим неравенство, которое называется неравенством Клаузиуса:
. Интегрируя обе части полученного выражения получим неравенство, которое называется неравенством Клаузиуса: 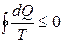 , которое для квазистатических (процессов, состоящих из непрерывно следующих друг за другом равновесных состояний) процессов переходит в равенство
, которое для квазистатических (процессов, состоящих из непрерывно следующих друг за другом равновесных состояний) процессов переходит в равенство 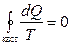 .
.
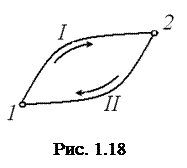 Пусть система может переходить из начального состояния 1 (рис. 1.18) в конечное состояние 2 несколькими способами, каждый из которых является квазистатическим процессом. Возьмём два из них I и II. Эти процессы можно объединить в один квазистатический круговой процесс 1" I "2" II "1. Применим равенство Клаузиуса:
Пусть система может переходить из начального состояния 1 (рис. 1.18) в конечное состояние 2 несколькими способами, каждый из которых является квазистатическим процессом. Возьмём два из них I и II. Эти процессы можно объединить в один квазистатический круговой процесс 1" I "2" II "1. Применим равенство Клаузиуса:
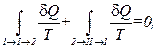 или
или
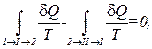 или, наконец,
или, наконец,
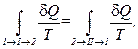 (1.78)
(1.78)
Количество теплоты, полученное системой, делённое на абсолютную температуру Т, при которой оно было получено, иногда называют приведённым количеством теплоты. Величина 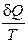 есть элементарное приведённое количество теплоты, полученное в бесконечно малом процессе, а интеграл
есть элементарное приведённое количество теплоты, полученное в бесконечно малом процессе, а интеграл  можно назвать приведённым количеством теплоты, полученным в конечном процессе. Тогда равенству Клаузиуса (1.78) можно дать следующую формулировку: приведённое количество теплоты, квазистатически полученное системой, не зависит от пути перехода, а определяется лишь начальным и конечным положениями системы. Этот результат позволяет ввести новую функции состояния – энтропию. То есть энтропия – функция состояния.
можно назвать приведённым количеством теплоты, полученным в конечном процессе. Тогда равенству Клаузиуса (1.78) можно дать следующую формулировку: приведённое количество теплоты, квазистатически полученное системой, не зависит от пути перехода, а определяется лишь начальным и конечным положениями системы. Этот результат позволяет ввести новую функции состояния – энтропию. То есть энтропия – функция состояния.
Рассчитаем энтропию идеального газа. Для этого используем первое начало термодинамики:
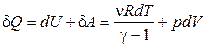 . (1.79)
. (1.79)
Подставим (1.79) в выражение, определяющее энтропию:
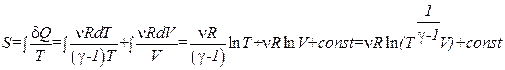 . (1.80)
. (1.80)
Это равенство также доказывает, что энтропия – функция состояния, поскольку при выводе не было сделано никаких предположений по поводу происходящего в системе процесса.
Date: 2015-05-05; view: 1174; Нарушение авторских прав