
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Модель идеального газа. Основное уравнение состояния идеального газа. Основные газовые законы
|
|
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
Используя зависимость давления идеального газа от его температуры и концентрации молекул
p = nkT,можно найти связь между основными макроскопическими параметрами газа — объемом V, его давлением p и температурой T.
Концентрация n молекул газа равна
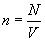 , (26.1)
, (26.1)
где N — число молекул газа в сосуде объемом V. Число N можно выразить как произведение количества вещества на постоянную Авогадро NA:
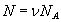 . (26.2)
. (26.2)
Из выражений (25.9), (26.1) и (26.2) получаем
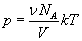 . (26.3)
. (26.3)
Произведение постоянной Авогадро NA на постоянную Больцмана k называется молярной газовой постоянной R. Молярная газовая постоянная равна
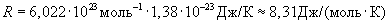 . (26.4)
. (26.4)
Используя молярную газовую постоянную, выражение (26.3) преобразуем в уравнение
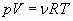 . (26.5)
. (26.5)
Количество вещества можно найти, зная массу вещества m и его молярную массу M:
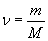 , (26.6)
, (26.6)
поэтому уравнение (26.5) можно записать в такой форме:
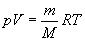 . (26.7)
. (26.7)
Это уравнение называется уравнением состояния идеального газа.
Изотермический процесс. Закон Бойля-Мариотта.Изотермическим процессом называется процесс, протекающий при постоянной температуре T. Из уравнения состояния идеального газа (26.7) следует, что при постоянной температуре T и неизменных значениях массы газа и его молярной массы M произведение давления p газа на его объем V должно оставаться постоянным:
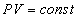 . (26.8)
. (26.8)
Изотермический процесс можно осуществить, например, путем изменения объема газа при постоянной температуре.
График изотермического процесса называется изотермой. Изотерма, изображенная в прямоугольной системе координат, по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его объем, является гиперболой (рис. 88).
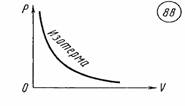
Уравнение (26.8), устанавливающее связь между давлением и объемом газа при постоянной температуре, было получено из эксперимента до создания молекулярно-кинетической теории газов в 1662 г. английским физиком Робертем Бойлем (1627 — 1691) и в 1676 г. французским физиком Эдмом Мариоттом (1620—1684). Поэтому это уравнение называют законом Бойля — Мариотта.
Изохорный процесс. Изохорным процессом называется процесс, протекающий при неизменном объеме V и условии m = const и M = const.
При этих условиях из уравнения состояния идеального газа (26.7) для двух значений температуры T0 и T следует
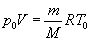 и
и 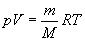 ,
,
или
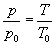 ,
, 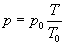
Если T0 выбрать равным 273 К (0 °С), то 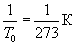 .
.
Обозначив 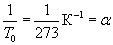 , получим уравнение для изохорного процесса
, получим уравнение для изохорного процесса
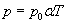 , (26.9)
, (26.9)
где p — давление газа при абсолютной температуре T, p0 — давление газа при температуре 0 °С, — температурный коэффициент давления газа, равный 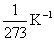 .
.
График уравнения изохорного процесса называется изохорой. Изохора, изображенная в прямоугольной системе координат, по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его абсолютная температура, является прямой, проходящей через начало координат (рис. 89). 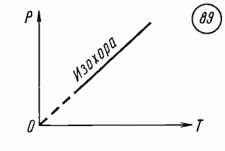
Экспериментальным путем зависимость давления газа от температуры исследовал французский физик Жак Шарль (1746—1823) в 1787 г. Поэтому уравнение (26.9) называется законом Шарля.
Изохорный процесс можно осуществить, например, нагреванием воздуха при постоянном объеме.
Изобарный процесс. Изобарным процессом называется процесс, протекающий при неизменном давлении p и условии m = const и M = const.
Таким же способом, как это было сделано для изохорного процесса, можно получить для изобарного процесса уравнение
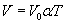 , (26.10)
, (26.10)
где V — объем газа при абсолютной температуре T, V0 — объем газа при температуре 0 °С; коэффициент, равный, называется температурным коэффициентом объемного расширения газов.
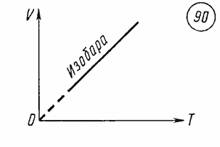
График уравнения изобарного процесса называется изобарой. Изобара, изображенная в прямоугольной системе координат, по оси ординат которой отсчитывается объем газа, а по оси абсцисс — его абсолютная температура, является прямой, проходящей через начало координат (рис. 90).
Экспериментальное исследование зависимости объема газа от температуры провел в 1802 г. французский физик Жозеф Гей-Люссак (1778—1850). Поэтому уравнение (26.10) называется законом Гей-Люссака.
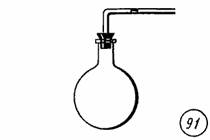
Изобарный процесс происходит, например, при нагревании или охлаждении воздуха в стеклянной колбе, соединенной со стеклянной трубкой, отверстие в которой закрыто небольшим столбом жидкости
Закон Дальтона
один из основных газовых законов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов.
Закон Паскаля
основной закон гидростатики: давление, производимое внешними силами на поверхность жидкости или газа, передается одинаково по всем направлениям.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
один из основных законов термодинамики, согласно которому невозможен периодический процесс единственным результатом которого является совершение работы, эквивалентной количеству теплоты, полученному от нагревателя. Другая формулировка: невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от менее нагретого тела к более нагретому. В.з.т. выражает стремление системы, состоящей из большого количества хаотически движущихся частиц, к самопроизвольному переходу из состояний менее вероятных в состояния более вероятные. Запрещает создание вечного двигателя второго рода.
Date: 2015-05-04; view: 1799; Нарушение авторских прав