
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Раздел 1. Электрическая цепь и ее основные законы
|
|
1. ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВ И ФИЗИЧЕСКОЙ ПРИРОДЕ ЭЛЕКТРИЧЕСТВА. 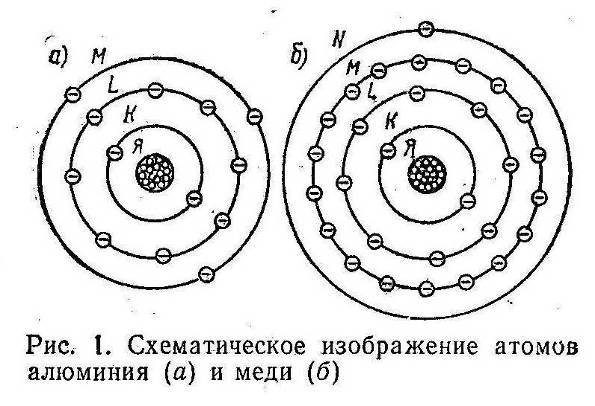 Строение вещества. Наукой установлено, что все тела состоят из отдельных очень малых частиц — атомов и молекул. В природе, имеется свыше 100 видов атомов, которые различаются массой и химическими свойствами. Каждый химический элемент — водород, гелий, кислород, углерод, железо, медь, алюминий, золото, радий, уран и пр. — состоит из атомов определенного вида. Молекулы образованы из нескольких атомов одного или различных химических элементов. Например, молекулы воды содержат атомы водорода и атомы кислорода, молекулы поваренной соли — атомы хлора и атомы натрия и т. д.
Строение вещества. Наукой установлено, что все тела состоят из отдельных очень малых частиц — атомов и молекул. В природе, имеется свыше 100 видов атомов, которые различаются массой и химическими свойствами. Каждый химический элемент — водород, гелий, кислород, углерод, железо, медь, алюминий, золото, радий, уран и пр. — состоит из атомов определенного вида. Молекулы образованы из нескольких атомов одного или различных химических элементов. Например, молекулы воды содержат атомы водорода и атомы кислорода, молекулы поваренной соли — атомы хлора и атомы натрия и т. д.
Строение атома весьма сложно. Упрощенно атом можно представить в виде ядра, окруженного оболочкой. Оболочка образована из постоянно движущихся с чрезвычайно большой скоростью мельчайших частиц — электронов, ядро — из протонов и нейтронов. Атомы настолько малы, что их нельзя увидеть даже в самый сильный микроскоп. В атомах разных химических элементов содержится различное количество протонов, нейтронов и электронов.
Электроны располагаются вокруг ядра Я (рис. 1) несколькими слоями (оболочками) на очень большом по сравнению со своими размерами расстоянии. Оболочки обозначаются латинскими буквами К, L, М, N, О, Р и Q (в порядке удаления их от ядра). Самым простым атомом является атом водорода: он имеет только один электрон, расположенный на оболочке К. Атом гелия (рис. 2, а) имеет два электрона, расположенных на оболочке К; атом кислорода (рис 2, б) — восемь электронов, расположенных на оболочках K и L. В атоме алюминия (см.рис. 1, а) электроны располагаются на трех электронных оболочках; в атоме меди (см. рис 1,б) — на четырех оболочках. В наиболее сложных атомах радия и урана электроны располагаются на всех семи возможных оболочках. В пределах каждой оболочки электроны могут двигаться вокруг ядра только по строго определенным или, как их принято называть, разрешенным орбитам (см. рис. 2).
 Согласно еовременным представлениям каждый из имеющихся в атоме электронов стремится занять одну из ближайших к ядру разрешенных орбит, остальные возможные орбиты пустуют. Электрон, вращающийся на самой близкой к ядру орбите, обладает минимальным количеством энергии, а вращающийся на самой удаленной — максимальной энергией (точно так же, как маховик малого диаметра может запасти значительно меньше энергии, чем маховик большого диаметра). Переход электрона с одной орбиты на другую связан с изменением его энергетического уровня.
Согласно еовременным представлениям каждый из имеющихся в атоме электронов стремится занять одну из ближайших к ядру разрешенных орбит, остальные возможные орбиты пустуют. Электрон, вращающийся на самой близкой к ядру орбите, обладает минимальным количеством энергии, а вращающийся на самой удаленной — максимальной энергией (точно так же, как маховик малого диаметра может запасти значительно меньше энергии, чем маховик большого диаметра). Переход электрона с одной орбиты на другую связан с изменением его энергетического уровня.
Электроны, расположенные на внешней, самой удаленной от ядра оболочке, называются валентными. Ими определяются способность атомов данного элемента вступать в химические связи между собой и с атомами других элементов, а также электропроводность различных материалов.
Ядро и электроны обладают электрическими зарядами. Протоны имеют положительный заряд, электроны — отрицательный. Заряды протона и электрона равны между собой. Нейтроны не имеют электрического заряда, т. е. являются нейтральными частицами. Между отрицательно заряженными электронами и положительно заряженным ядром возникают элетктрические силы, которые удерживают электроны в атоме и заставляют их двигаться вокруг ядра. Эти электрические силы определяют и размеры атомов. При очень тесном сближении двух атомов возникают огромные силы отталкивания между их электронами. Они препятствуют дальнейшему сближению и определяют объем, занимаемый атомом; внутрь этого объема не может проникнуть другой атом.
Ядра атомов являются значительно более устойчивыми системами, чем их электронные оболочки. Объясняется это тем, что между протонами и нейтронами действуют огромные силы взаимного притяжения, называемые ядерными силами. Эти силы значительно больше сил взаимного отталкивания между одноименными электрическими зарядами протонов. Поэтому ядра атомов большинства химических элементов разделить на части очень трудно. Существуют, однако, и такие вещества (радий, уран, плутоний и др.), ядра атомов которых постепенно и самопроизвольно распадаются с выделением энергии. Эта энергия уносится в пространство в виде излучений. Такие вещества называются радиоактивными. Энергию, выделяющуюся при самопроизвольных, а также вызванных искусственным путем превращениях ядер атомов, называют атомной, иди ядерной энергией.
Несмотря на то, что все атомы состоят из электрически заряженных частиц, мы не наблюдаем электрических сил притяжения и отталкивания между окружающими нас телами. Это происходит потому, что общий отрицательный заряд всех электронов в атоме равен положительному заряду ядра, а атом в целом электрически нейтрален. Поэтому и тело, состоящее из атомов, не обладает электрическим зарядом и не проявляет электрических свойств.
Атомы различных элементов отличаются друг от друга не только числом электронов, но и строением ядер. Чем больше электронов в оболочке атома, тем больше должно быть протонов в его ядре. Заряд ядра зависит от числа положительных частиц—протонов. Масса ядра атома зависит от числа протонов и нейтронов.
В природе существует несколько видов атомов, имеющих одинаковый заряд ядра, но разную массу. Это означает, что атомы таких элементов содержат одинаковое число протонов, но различное число нейтронов. Такие атомы получили название изотопов. Радиоактивные изотопы, которые нашли сейчас широкое применение в науке и технике, можно получать искусственным путем в так называемых реакторах.
Физическая природа электричества. Многие электрические явления и электрические свойства тел можно весьма просто и наглядно объяснить на основе электронной теории. Согласно этой теории атомы при определенных условиях могут терять электроны или приобретать их от соседних атомов. В этом случае они перестают быть нейтральными, так как равновесие их электрических зарядов нарушается. Атомы, потерявшие часть своих электронов, становятся положительно заряженными и называются положительными ионами. Атомы, получившие избыточные электроны, становятся отрицательно заряженными и называются отрицательными ионами.
Процесс превращения нейтральных атомов в электрически заряженные частицы — ионы — называют ионизацией. Ионизация может возникнуть только при сообщении атому определенного количества энергии: в виде тепла, путем бомбардировки его какими-либо частицами, при воздействии внешнего электрического поля и т. д. Наибольшая энергия требуется для освобождения валентных электронов. При сообщении атому сравнительно небольшой энергии валентные электроны кратковременно переходят на более удаленную орбиту, а затем перескакивают на прежнюю, более близкую к ядру. Однако при достаточно большой энергии (энергии ионизации) эти электроны могут совершенно оторваться от ядра и стать свободными.
Если в каком-либо теле накопятся электроны или ионы, то говорят, что в теле накопилось электричество. Такое тело становится электрически заряженным и приобретает электрические свойства. Эти свойства есть по сути дела проявление электрических сил, действующих между электронами и ядрами атомов. Тело, приобретая электроны, тем самым получает отрицательный заряд. При потере электронов тело приобретает положительный заряд.
Электрические заряды. Количество электричества, содержащееся в заряженном теле, называется электрическим зарядом. Заряды бывают двух знаков: положительные (обозначаются знаком «+») и отрицательные (обозначаются знаком «—»).
Единицей электрического заряда в физике принято считать заряд электрона. В этих единицах измеряют количество электричества, запасенное в атомах разных веществ. Однако заряд электрона очень мал, поэтому им практически неудобно измерять количество электричества, проходящее по проводам или поступающее в различные электрические устройства. В практической электротехнике для измерения электрических и магнитных величин принята Международная система единиц (СИ — система интернациональная). В этой системе электрические заряды, т. е. количество электричества, измеряют в кулонах (Кл); 1 Кл больше заряда электрона в 6,29·1018 раз. Если по проводу прошло 6,29·1018 электронов, то говорят, что по проводу прошло количество электричества, равное 1 Кл.

При взаимодействии электрических зарядов (электрически заряженных тел) между ними возникают электрические силы притяжения или отталкивания. Одноименные заряды создают силы отталкивания, разноименные — силы притяжения (рис. 3).
Date: 2015-11-13; view: 1080; Нарушение авторских прав