
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическая кинетика
|
|
Для гомогеннойхимической реакции
аА + вВ = сС + dD (1)
реагенты продукты
скорость (v) выражается количеством (nj) одного из реагентов J (или продуктов), прореагировавшим (образовавшимся) в единицу времени  в единице реакционного пространства V:
в единице реакционного пространства V:
 .
.
Если V=const, то мгновенная скорость (т.е. скорость в данный момент времени  ) определяется производной от концентрации по времени:
) определяется производной от концентрации по времени:
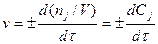 ,
,
где Сj - молярная концентрация вещества J.
Знак «-» ставится, если вещество J -реагент, знак «+» - если вещество J – продукт.
Средняя скорость реакции vср в интервале времени от 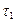 до
до 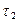 определяется соотношением:
определяется соотношением: 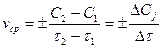 . (2)
. (2)
Скорость химической реакции зависит от многих факторов, основными из которых являются:
- концентрация (или давление для газообразных реагентов),
- температура;
- наличие катализаторов;
- площадь поверхности раздела фаз (для гетерогенных реакций).
Зависимость скорости простой реакции (т.е. реакции, идущей в одну стадию) от концентрации реагентов выражается законом действующих масс (ЗДМ): при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Так, для гомогенной реакции (1) скорость, согласно ЗДМ выражается соотношением
 =
=  (СА )а ∙(СВ )b;
(СА )а ∙(СВ )b;  =
=  (СС)с ∙(СD)d, (3)
(СС)с ∙(СD)d, (3)
где  - скорость прямой реакции;
- скорость прямой реакции;
 - скорость обратной реакции;
- скорость обратной реакции;
k- коэффициент пропорциональности, называемый константой скорости химической реакции.
При СА = СВ = 1 моль/дм3  =
=  , при СD = СС = 1 моль/дм3
, при СD = СС = 1 моль/дм3  =
=  ;
;
СА, СВ, СD, СС - концентрации веществ A,B,C,D, моль/дм3;
a,b,c,d - стехиометрические коэффициенты в уравнении реакции.
Константа скорости химической реакции определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции.
Если одно из реагирующих веществ:
1) взято в избытке,
2) находится в кристаллическом состоянии, или концентрация его не изменяется по другим причинам, то концентрация этого вещества не входит в выражение закона действующих масс. Так, для реакции
СаОк + С02,г = CaC03,k  =
=  С(C02 ).
С(C02 ).
Сложные химические реакции протекают через ряд промежуточных стадий - элементарных актов. В одном элементарном акте может участвовать минимальное число частиц: одна или две (редко три). В связи с этим стехиометрическое уравнение сложной химической реакции не отражает истинного механизма взаимодействия исходных веществ, а фиксирует лишь начальное и конечное состояние системы.
При решении задач по химической кинетике необходимо различать следующие понятия:
1. Исходная концентрация реагирующего вещества - то количество вещества в 1 дм3 раствора или газа, которое берется для химического взаимодействия.
2. Количество вещества в 1 дм3, вступившего в химическое взаимодействие (изменение концентрации). В химическое взаимодействие вступает не все взятое количество вещества, а лишь часть его. Эта часть вещества может быть задана либо в процентах от исходного количества, либо в молях, либо неизвестно, какое количество вещества вступило в химическое взаимодействие. В этом случае количество в 1 дм3 одного из веществ, вступившего в реакцию, обозначают через X, а количество остальных взаимодействующих веществ выражается через X, пропорционально стехиометрическим коэффициентам данной реакции.
3. Текущая концентрация означает количество вещества в 1 дм3, имеющееся в наличии на данный момент.
Date: 2015-11-13; view: 628; Нарушение авторских прав