
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

М —отдаленные метастазы
|
|
МО — нет признаков отдаленного метастазирования
M1a — солитарный метастаз в лимфатический узел, доступный удалению.
Mlb — неудалимые отдаленные метастазы в лимфатические узлы.
М2 — метастазы в другие органы.
Клиника. При раке пищевода больные обычно жалуются на дисфагию. Могут быть и другие жалобы (боли в отдаленных от пищевода участках тела, гиперсаливация, отрыжка, изжога, тошнота, срыгивание, рвота, кашель, изменение голоса, похуда-ние, слабость, повышение температуры и др.), которым не всегда придается должное значение. В связи с этим распространено мнение, что клиническая картина рака пищевода хорошо изучена, симптомы заболевания однообразны и типичны, а установление диагноза не составляет больших трудностей. Однако анамнез больных, поступающих на стационарное лечение, указывает на большую длительность заболевания, по данным
Ю. Е. Березова (1965), В. С. Рогачевой (1969) — 7 мсс, по данным ОНЦ АМН СССР — до 8 мес.
В начале заболевания установление диагноза очень затруднительно, так как начало болезни у ряда больных проявляется совсем не «местными» признаками. В табл. 7 приведены данные, полученные при изучении апамнеза 500 больных (А. И. Рудерман).
Таблица 7 Частота первых симптомов рака пищевода
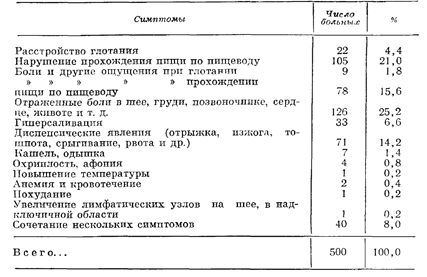
Углубленное изучение клинической картины рака пищевода позволило выделить три группы больных.
Первую группу составляют больные, у которых ранее были рубцовые изменения в пищеводе после химического и термического ожога, эзофагиты, доброкачественные опухоли, дивертикулы и др. У этих больных появлению признаков рака пищевода предшествует комплекс клинических симптомов первичного заболевания. Начало озлокачествления устанавливается по нарастанию симптомов, появлению новых признаков и ухудшению общего состояния.
Вторую группу составляют больные с общими симптомами, указывающими на начало тяжелого заболевания, локализация и сущность которого неясны. Имеются в виду быстрая утомляемость, адинамия, медленная анемизапия, понижение аппетита и др. Первыми симптомами рака пищевода у больных этой группы могут быть слюнотечение, икота и только затем дисфа-гня.
Третью группу составляют больные со скрытым течением— так называемым немым раком пищевода. Диагноз в этом случае обычно ставят при наличии метастазов или прорастании в соседние органы.
Некоторые авторы говорят о типичной (явно пищеводной) и нетипичной формах рака пищевода. Среди последних называют «гастритическую», «псевдоангинозную», «гортанную», «легочную» и др.
У наблюдавшихся нами 500 больных по клиническому течению можно было выделить следующие формы рака пищевода:
пищеводная—у 49%, ларпнготрахеальная — у 8%, сердечная — у 9%, плевропульмональная — у 5%, гастритическая— у 14%, невралгическая — у 10%, смешанная—у 5% (А. И. Ру-дерман,1973).
Изучение начальных фаз развития рака пищевода позволило нам сделать ряд важных для практики выводов. В ранних стадиях, когда больные выглядят здоровыми людьми, любые, даже минимальные ощущения в области пищевода, тем более связанные с нарушением глотания, должны привлечь внимание врача. Следует помнить, что выявление объективных симптомов злокачественной опухоли хотя и представляет трудности, но возможно при комплексном обследовании с использованием всех имеющихся диагностических методов.
Даже в поздних стадиях развития болезни (III и IV), когда доминирующими симптомами становятся нарастающая дис-фагия, мучительные боли, выраженная интоксикация и др., необходимо добиваться гистологической верификации диагноза. Практика располагает достаточным числом фактов, когда на вскрытиях лиц, умерших якобы от рака пищевода, выявлялись другие заболевания.
Симптомы болезни зависят от анатомического роста опухоли и уровня поражения пищевода. При экзофитных опухолях дис-фагия появляется не всегда и сравнительно поздно. Обтурации пищевода при таких опухолях может долго не быть, больные не страдают от голода и не худеют. Симптомы прорастания опухоли в органы средостения выявляются чаще при поражении среднегрудного отдела. При прорастании в клетчатку появляются боли в межлопаточном пространстве, а прорастание нервных стволов приводит к неврологическим расстройствам (ощущение жара, боли в плече и руке, повышенная потливость, парестезии, межреберные боли и др.). При прорастании опухоли в стенку бронха или трахеи вначале появляется кашель, а при формировании пищеводно-бронхиального или пище-водно-трахеального свища — соответствующая симптоматика (приступы изнурительного кашля во время еды с отхаркиванием принятой пищи, аспирационная пневмония и т. п.). Перфорация опухоли в средостение вызывает гнойный медиастннит. При прорастании крупного сосуда наступает тяжелое (обычно смертельное) кровотечение.
Распространенные опухоли верхнего отдела пищевода, особенно шейного, дают признаки поражения трахеи. Нередко поражаются возвратные нервы и развивается афония.
Следует иметь в виду, что выраженная клиническая картина при раке пищевода может быть и при небольших опухолях, иногда вполне излечимых, но вызывающих стойкую дисфагию. В таких случаях больные могут погибнуть от истощения или вследствие прободения, до возникновения отдаленных метастазов. Несмотря на тяжелое состояние таких больных, после соответствующей подготовки иногда можно выполнить радикальную операцию.
Диагностика. Достоверный диагноз почти не может быть поставлен на основе какого-либо одного признака. Только сопоставление результатов комплексного исследования пищевода различными методами и данных клиники в большинстве случаев помогает поставить диагноз рака пищевода.
Важное значение имеют данные анамнеза, статус больного и материалы диагностических методов исследования (рентгенологического, эзофагоскопии, биопсии, цитологического изучения отпечатков или смывов со слизистой оболочки, индикации радиоактивным фосфором и др).
Рентгенодиагностика. Наиболее легко пищевод изучается рентгеноконтрастным исследованием, при введении в его просвет водных взвесей химически чистого сульфата бария различной консистенции. При этом дополнительно применяется специальный способ выявления пищеводной стенки (париетогра-фия), который дает представление о функциональном и анатомическом ее состоянии. Такие достаточно достоверные представления о состоянии и особенностях стенок пищевода на различных уровнях могут быть получены при рентгенологическом исследовании в различных положениях: вертикальном, горизонтальном и т. д.
О внутреннем слепке пищевода и функции его в различные фазы прохождения комка контрастной взвеси можно судить во время рентгеноскопии. Фиксировать отдельные моменты заполнения пищевода, выявить элементы макроструктуры его внутренней поверхности (складки слизистой оболочки, ложбинки между ними) позволяет рентгенография. Перистальтику и сократительную способность стенок пищевода документирует рентгенокимография. Должны быть подчеркнуты достоинства в дифференциальной рентгенодиагностике рака пищевода рент-генокинематографии, которая не только сочетает достоинства перечисленных методов, но и дает возможность многофакторного и многократного анализа функции и рентгепо-морфоло-гии органа без повторных и дополнительных исследований.
Рентгенологический диагноз рака пищевода основывается на выполнении следующих признаков:
1) нарушение структуры рельефа слизистой оболочки пищевода;
2) обнаружение дефекта наполнения;
3) наличие тени опухолевого узла;
4) отсутствие перистальтики стенки пищевода.
В запущенных случаях обычно имеются все или по крайней мере три из перечисленных четырех признаков. Трудно выявляемым, но самым ранним п достоверным рентгенологическим признаком рака пищевода является выпадение перистальтики. Этот признак обычно бывает первым и может долго оставаться единственным симптомом рака. Несколько позже обнаруживаются и другие признаки. Иногда это перестройка или разрушение рельефа слизистой оболочки, проявляющееся атипичной формой и расположением складок, бесформенными отложениями контрастного вещества или мелкими участками просветления. Чаще обнаруживается дефект наполнения, величина которого зависит от фазы развития опухоли. В начальной фазе, когда имеется лишь небольшой участок инфильтрации стенки пищевода, обнаруживается едва заметный (плоский, иногда волнистый, нечеткий или шероховатый) дефект наполнения, отображающий инфильтрацию. Нередко можно видеть тень опухолевого узла в виде муфты, охватывающей измененный участок пищевода, или полуовального уплотнения, прилегающего к измененному участку стенки.
Рентгенологические признаки рака пищевода зависят не только от стадии заболевания. Существенное значение имеют особенности роста опухоли и ее локализация. Все это создаст многообразие рентгенологических картин (рис. 39—43).
Поздние стадии рака, клинически проявляющиеся частичной или полной непроходимостью пищевода, рентгенологически выявляются резким сужением или полной задержкой столба контрастной взвеси в пищеводе. Перфорация опухоли в прилегающие органы имеет типичную картину: контрастная взвесь задерживается у места расположения опухоли, затем проникает в нижележащий отдел пищевода, но одновременно от одной из стенок пищевода отделяется контрастная полоска. Если свищ сообщается с трахеей или бронхом, то можно видеть заполнение контрастным веществом бронхиального дерева (рис. 44). О существовании эзофаготрахеальной или эзофагобронхиальной фистулы можно уверенно говорить лишь после выявления самого свищевого хода. Нередко паралич или парез гортанного нерва сопровождается затеканием бариевой взвеси в воздухоносные пути из гортаноглотки.
Высоко оценивая рентгенологический метод исследования, необходимо подчеркнуть, что отдельно взятые рентгенологические симптомы не должны служить основанием для безусловного диагноза рака пищевода. Достоверный диагноз основывается только на результатах сопоставления рентгенологических данных с клинической картиной болезни и материалами других методов исследования.
Эндоскопическое исследование. Эзофагоскопию следует производить после рентгенологического исследования. При этом необходимо делать биопсию опухоли или подозрительного патологического очага. Отрицательный результат эзофагоскопии не является основанием для того, чтобы отвергнуть диагноз рака пищевода. Небольшую опухоль или язву иногда трудно заметить, так как растянутая стенка пищевода выше места поражения может нависать и закрывать патологический очаг. При инфильтративно растущей по подслизистому слою опухоли эзофагоскопия иногда выявляет только сужение пищевода и препятствие для прохождения трубки. При таком росте опухоли взятый для биопсии участок слизистой оболочки пищевода также может не подтвердить диагноза рака. В трудных для диагностики случаях эзофагоскопию следует повторить под наркозом, при котором снимается спазм пищевода п более легко осматриваются все отделы. Для биопсии выбирают ткани, расположенные на границе здоровой слизистой оболочки и опухоли. Легче диагностируются экзофитно растущие опухоли.
При эзофагоскопии раковая опухоль бледно-розовая, нередко с серым налетом, легко кровоточит при дотрагивании. При язвенных формах рака обычно удается увидеть подрытый край
язвы с плотными инфильтрированными стенками. При ннфиль-тративных опухолях определяется равномерное, часто циркулярное сужение. На высоте сужения можно обнаружить плоскую язву. Слизистая оболочка над опухолевым инфильтратом может быть малоизмененной, но чаще всего она бледна, плохо смещается относительно подлежащего слоя. При эзофагоскопии могут быть выявлены и косвенные признаки — ригидность стенки пищевода, повышенное содержание слизи, бледность, цианотпческий оттенок слизистой оболочки на ограниченном участке.
Цитологическая диагностика. Способы взятия материала из просвета пищевода различны. С помощью ватного тампона, смоченного изотоническим раствором хлорида натрия, производят отпечатки; можно аспири-ровать содержимое или исследовать смыв. Последний центрифугируют и изготовляют натив-ные и окрашенные препараты. Характер расположения клеток п морфология отдельных элементов зачастую позволяют определить гистологическую структуру опухоли. И. Т. Шевченко (1950) с помощью прицельной аспирации у 100 больных с подозрением на рак пищевода в 92% обнаружил элементы злокачественного новообразования.
Следует помнить, что отрицательный результат цитологического исследования не исключает наличия рака.
Радиоизотопная диагностика. Для диагностики рака пищевода может быть использована
способность злокачественных опухолей интенсивно накапливать. и задерживать вводимый в организм фосфор. Радиоактивный фосфор, из расчета 1 мкКи на 1 кг массы тела больного, разведенный в изотоническом растворе хлорида натрия, вводят внутривенно. После этого на протяжении первых 48 ч, а в некоторых случаях и через 72 ч измеряют интенсивность излучения на разных участках стенки пищевода внутриполостным бета-зондом — газоразрядным счетчиком. Обязательным условием получения достоверных сведений является подведение заключенного в зонд датчика, регистрирующего излучение, к поверхности опухоли или слизистой оболочке пищевода. Это обусловлено проникающей способностью бета-частиц в среднем па 4—5 мм. Зонд вводят под контролем экрана в рентгеновском кабинете или во время эзофагоскопии. Вначале датчик устанавливают в области кардии, затем постепенно перемещают кверху 'и через каждые 0,5—1 см измеряют интенсивность излучения. Таким образом определяют локализацию и протяженность участка стенки пищевода с повышенной интенсивностью' накопления ^Р. Последнее выражается в процентах к накоп гению в здоровых участках пищевода.
Радиоизотопное исследование после операции плп луче ной терапии позволяет судить о радикальности проведенного лечения. Однако данные о злокачественности, полученные в результате радиоактивной индикации, не следует переоценивать.
Электроэзофагография. Как известно, биоэлектрические потенциалы тонко отражают нервномышечную активность стенки пищевода, поэтому с помощью регистрации биопотенциалов. можно судить о двигательной функции различных отделов пищевода.
Перспективным для комплексной диагностики рака пищевода следует признать метод многоканальной электроэзофагографии с поверхности тела.
Таким образом, тщательное изучение анамнеза и состояния больного в сопоставлении с данными комплексного исследования разными методами (рентгенологическим, эзофагоскопией, цитологическим, радиоиндикацией и электроэзофагографией) дают наиболее полную информацию, позволяющую в большинстве случаев отвергнуть или обосновать достоверный диагноз рака пищевода. При этом наиболее рациональным нужно считать следующий порядок проведения диагностических мероприятий: углубленный анализ истории заболевания и состояния больного, рентгенологическое исследование, эзофагоскопия с биопсией, цитологическое исследование отпечатков слизистой оболочки, индикация радиоактивным фосфором, электроэзофаго-графия.
Принципиально недопустимо лучевое лечение или химиотерапия без морфологически верифицированного диагноза.
Для выбора целесообразного метода лечения весьма важна правильная оценка степени распространения опухоли. Объективные данные для этого дают рентгенологическое исследование, эзофагоскопия, индикация радиоактивным фосфором и тра-хеобронхоскопия.
Дифференциальная диагностика. Рак пищевода следует дифференцировать сахалазией (кардиоспазмом),рубцовым сужением и язвой пищевода, эзофагитом, доброкачественными опухолями, варикозным расширением вен пищевода, дивертикулами, сдавлением пищевода извне (опухолями средостения, рубцамп после медиастинита), аномальным расположением сосудов в средостении, а также дисфагией при малокровии. Нередко представляют диагностические трудности острые воспалительные изменения пищевода, связанные с травмой у пожилых людей. Ниже приводятся заболевания, которые наиболее часто вызывают трудности при дифференциальной диагностике.
Ахалазиеи (рис. 45) болеют в основном молодые и люди среднего возраста. Анамнез длительный, продолжительны периоды улучшения состояния. Основной симптом — дисфагия усугубляется после волнении. Дисфагия непостоянна и не имеет тенденции к прогрессированию, как при раке. Во время приема пищи для снятия спазмов больные часто изменяют положение тела, запивают пищу горячей или холодной водой.
Дисфагии при кардиоспазме снимаются иногда систематическим применением атропина перед едой. При раке пищевода большого расширения его выше места сужения не наблюдается, тогда как при кардноспазме описаны случаи расширения диаметра пищевода до 10 см и более (В. В. Уткин, 1967).
Среди методов дифференциальной диагностики большое место занимает рентгенологическое исследование. При кардиоспазме сужение имеет воронкообразную форму, тогда как при раке контуры суженного участка зазубрены. При кардиоспазме после раздувания пищевода задержавшаяся в пищеводе контрастная взвесь проваливается в желудок, и раздувается кардпя. Этого не бывает при раке пищевода. Дифференциальная диагностика становится затруднительной при длительно существующих ахалазиях, сопровождающихся Рубцовыми изменениями в кардип и эзофагитом. В этих случаях нужно помнить о возможности развития рака на фоне кардиоспазма.
Рубцов ые сужения пищевода (рис. 46) возникают после химического и термического повреждения стенок. Дисфагия при этом всегда стойкая, анамнез длительный. Рентгенологическая картина рубцового сужения пищевода при учете анамнеза ясна. Контуры симметрично суженного участка волнистые, часто сужение занимает большое протяжение. Су-прастенотическое расширение пищевода бывает значительным. При этом заболевании не следует забывать о возможности развития рака.
Язвы пищевода (рис. 47) неопухолевого происхождения встречаются довольно редко. В ОНЦ АМН СССР из 247 больных с различными заболеваниями пищевода такие язвы наблюдались лишь у 4. Пептические язвы чаще встречаются в брюшном и нижнегрудном отделах пищевода. При язве пищевода преобладают болевые ощущения во время прохождения пищи, дпсфагия, снимающаяся применением антиспастических средств, нередки кровотечения. Исходом их может быть рубцо-вое сужение. Рентгенологически язвы очень трудно дифференцировать от язвенной формы рака, поэтому большое значение имеет эзофагоскопия с биопсией и цитологическим изучением мазков. Во время эзофагоскопии при язвах выявляется эзофа-гит, который может сопровождаться изъязвлением. Слизистая -оболочка в таких случаях сочная, гиперемированная с инъецированными сосудами.
Эзофагит, возникший вследствие незамеченной больным травмы (царапина, ожог и т. п.) или регургитации и раздражения слизистой оболочки пищевода желудочным соком, также может давать синдром дисфагии. Хронический эзофагит приводит к рубцовым изменениям в мышечном слое пищевода. При рентгенологическом исследовании выявляются ригидность стенок пищевода, а также сглаженность или резкое утолщение складок слизистой оболочки. Крайне редко обнаруживаются
ниши, соответствующие эрозивным участкам. При эзофагитах не бывает выраженного сужения и супрастенотического расширения пищевода. Большое диагностическое значение имеет эзофагоскопия. При остром эзофагите слизистая оболочка гипере-мирована, отечна, эрозирована и легко кровоточит при дотра-гивании. При хронических эзофагитах слизистая оболочка,. наоборот, бледная со сглаженными продольными складками и эрозиями. После соответствующей диеты и лечения острые эзо-фагиты часто излечиваются.
Варикозное расширение вен пищевода имеет весьма характерную клинику. Основной симптом — повторяющееся кровотечение. Дисфагии иногда не бывает. Преобладают симптомы цирроза печени п нарушения кровообращения в системе воротной вены. Трудности в дифференциальной диагностике возникают, если изменения в нижнем отделе пищевода находят случайно при рентгеноскопии и отсутствии клинических проявлений гепато-лиеналыюго заболевания. Рентгенологически выявляются мелкие дефекты наполнения (рис. 48) округлой или вытянутой формы, соответствующие продольному расположению расширенных вон в подслизистом слое пищевода. Стенки пищевода при этом сохраняют эластичность. Эзофагоскопия при подозрении на варикозное расширение вен пищевода противопоказана из-за опасности кровотечения.
Стали чаще наблюдаться склерозирующие ме-диастиниты, при которых рубцовые изменения клетчатки средостения приводят к сдавлению и непроходимости пищевода. Такой медиастинит может возникнуть после воспалительных заболеваний легких, лимфаденита средостения. При этом заболевании имеются указания в анамнезе на хронические и острые процессы легких, беспричинные подъемы температуры. В сравнительно короткий срок появляется дисфагия, что позволяет думать о раке пищевода. В ряде случаев склерозирующий медиа-стинит трудно дифференцировать от рака пищевода, тем более что эти заболевания имеют сходную рентгенологическую картину: определяется сужение пищевода, иногда со значительным супрастено-тическим расширением. Контуры суженного участка ровные, реже волнистые. Рельеф слизистой оболочки сохранен. Важно, что стенка пищевода сохраняет некоторую эластичность, хотя при глотании и дыхании пищевод не смещается в средостении. Часто вокруг сужения пищевода удается видеть тень уплотненной склерозированной клетчатки.
Конфигурация пищевода может изменяться при рубцевании клетчатки и медиастинальной плевры без значительного сдав-ления пищевода. Хотя пищевод сужен и подвижность его резко ограничена, однако стенозирования пищевода не наступает и его проходимость при этом не нарушается. Сохраняется также перистальтика стенок пищевода.
В ОНЦ АМН СССР было 6 больных с рубцовым медиастини-том, симулировавшим рак пищевода, 3 из них пришлось оперировать в связи с невозможностью исключить рак.
У больных, страдающих малокровием и предъявляющих жалобы на расстройство глотания и неприятные ощущения в глотке.(так называемая дисфагия при малокровии), рентгенологическое исследование позволяет выявить на протяжении проксимальных 5—б см пищевода различной глубины втяжения или дефекты наполнения контуров стенок. Эти одиночные или множественные зазубрины пли перетяжки, суживающие просвет, обусловлены обнаруживаемыми при эзофагоскопии участками набухшей слизистой оболочки.
Мы не приводим здесь дифференциальную диагностику рака пищевода с рядом других изменений пищевода и соседних органов (возрастные изменения, дивертикулы, аномалии крупных сосудов и др.). Из-за редкости мы также не обсуждаем возможности дифференциальной диагностики с саркомой, ретпкулезом п другими злокачественными заболеваниями этого органа. Вместе с тем подчеркиваем, что дифференциальная диагностика заболеваний пищевода должна проводиться с учетом того, что рак пищевода — самое частое его заболевание. Успешное лечение возможно только при своевременном распознавании этого заболевания.
Лечение. Основные методы лечения рака пищевода — хирургический и лучевой. Попытки применения различных противоопухолевых препаратов пока реальным успехом пе увенчались. К сожалению, операцию можно выполнить у относительно небольшой группы больных.
Специальное лечение (хирургическое или лучевое) по данным анализа группы, включающей 2650 первично зарегистрпровап-пых по Москве больных раком пищевода (1969—1973), оказалось возможным только у 34,3%; у 56,6% лечение не проводт-лось в связи с пожилым возрастом и сопутствующими заболеваниями, 9,1% больных отказались от лечения. Радикальное хирургическое лечение оказалось возможным только у 3,8% зарегистрированных больных и у 11,1% лиц, подвергшихся лечению. Лучевое лечение проведено соответственно у 69,3% и 23,4% больных. Преобладание лучевых методов лечения вполне закономерно, если учесть значительный процент лиц пожилого возраста, которым нельзя выполнить радикальную операцию в связи с сопутствующими заболеваниями.
О широте возможностей применения хирургических и лучевых методов лечения рака пищевода свидетельствует госпитализация больных в лучевую и хирургические клиники ОНЦ АМН СССР.
Из обратившихся в поликлинику в хирургический стационар госпитализировано 12,8% больных, в клинику лучевой терапии — 34,1%; 43,1% больных не госпитализированы в связи с запущенным состоянием или направлены в терапевтическую клинику для попытки оказать помощь химиотерапией.
Результаты хирургического лечения рака пищевода малоутешительны. По сводным даным Krebs (1965), на 7254 радикально оперированных больных послеоперационная летальность составляла в среднем 25% (от 5,8 до 50%). Пережило 5 лет после операции всего 9,3% оперированных. По сводным данным В. С. Рогачевой (1968), пятилетняя выживаемость после хирургического лечения составляет 5,3—8,6%. Только некоторые хирурги приводят более высокую пятилетнюю выживаемость — 20—24%, правда, не указывая к какой группе больных она относится. Поэтому в последнее время пристальное внимание привлекает лучевое лечение. Современные постоянно совершенствующиеся методы облучения, а также использование новых источников излучения позволяют надеться на улучшение результатов лечения. В выборе метода лечения необходимо руководствоваться не только состоянием больного и стадией заболевания, но и опытом оперирующих хирургов, а также опытом и технической оснащенностью лучевого отделения.
Комбинированные (лучевые и хирургические) методы лечения и лекарственная терапия рака пищевода находятся в стадии научной разработки, и оценить их пока не представляется возможным. Показания к применению лучевых и хирургических методов лечения рака грудного отдела пищевода четко не определены. Они ясны только в тех случаях, когда в операции отказывают и остается единственная возможность — прибегнуть к лучевой терапии.
Лучевые методы лечения можно применить значительно большему числу больных ипоперабельной карциномой пищевода, пожилым людям с низкими функциональными показателями. Хирургические методы применимы у меньшего числа больных, — более молодых, крепких, с начальной стадией заболевания. При лучевой терапии больные не умирают от лечения, а операции чреваты большим риском. После успешного лучевого
лечения больной может с большей вероятностью возвратиться к труду и активной жизни, чем после операции. Однако, пользуясь критерием пятилетней выживаемости после лечения, следует признать преимущество хирургических методов и при этом учесть, что у всех оперированных был морфологически верифицированный диагноз и ошибки в диагностике исключены. Тем не менее большая перспектива пятилетней выживаемости, которую дает хирургический метод, значительно нивелируется невысоким процентом операбельности и значительным операционным риском.
Выбор метода лечения должен быть принципиально разным для рака нижнегрудного и среднегрудного отделов пищевода-Чем выше поражение пищевода, тем меньше шансов на хорошие результаты хирургического лечения. При раке нижнегрудного отдела пищевода хирургические методы лечения ведущие. Это обусловлено рядом обстоятельств. Отток лимфы и распространение раковых клеток при опухоли в диафрагмальной и наддиафрагмальной областях идет в основном вниз, в сторону паракардиальных лимфатических узлов и узлов желудочно-поджелудочной связки. При раке нижнегрудного отдела пищевода радикальной операция считается при отсечении пищевода выше опухоли на 8—10 см. Удаление малой кривизны желудка производят единым блоком с лимфатическими узлами, расположенными по малой кривизне желудка и в желудочно-поджелу-дочной связке.
Непосредственные результаты хирургического лечения рака ннжнегрудного отдела пищевода более благоприятны, чем среднегрудного отдела пищевода, и приближаются к таковым при хирургическом лечении рака кардии.
Лучевые методы лечения рака нижнегрудного отдела пищевода в связи с необходимостью облучать верхние отделы брюшной полости не нашли широкого применения. Вопрос о лучевой терапии можно ставить только после определения абсолютных противопоказаний к хирургическому лечению.
Выбор метода лечения при раке среднегрудного отдела пищевода представляет значительные трудности. В операбельных случаях решать, что лучше для больного: операция с высокой степенью операционного риска, но с надеждой попасть в число немногих, переживающих срок более 5 лет, или лучевая терапия с более верной возможностью прожить 2—3 года без риска, связанного с операцией? При сравнении результатов облучения п радикальных операций (проведенных П. Л. Нигап, 1973) оказывается, что число лиц, переживших год после хирургического лечения и подвергавшихся лучевой терапии, составляет 42,1 п 48,2%, показатели трехлетней выживаемости соответственно 16,6 it 15,9%, а пятилетней — 7,6 и 5,7%. Ухудшает возможности излечения хирургическим методом высокая послеоперационная летальность.
Отдаленные результаты хирургического и лучевого лечения в группе больных благополучено перенесших лечение, дает иную картину. Среди перенесших операцию переживают год 73,6% больных, из лечившихся облучением — 48,2%. Трехлетняя выживаемость составляет соответственно 25 и 15,9%, а пятилетняя — 12,2 и 5,7%. В последние годы мы отдаем предпочтение лучевым методам лечения рака среднегрудного отдела пищевода и оперируем только тех больных, у которых это лечение оказывается неэффективным — после получения половинной дозы в 3000—4000 рад, а также тех, у кого нет морфологической верификации диагноза. Такая тактика оправдана тем, что при малой разнице результатов хирургического и лучевого лечения рака среднегрудного отдела пищевода мы прибегаем к весьма рискованной операции, испытав сначала менее опасный метод.
Хирургическое лечение рака пищевода один из самых сложных разделов хирургии и онкологии. Разработка методов оперативного вмешательства принадлежит русским хирургам сибирской школы, i
В 1888 г. И. И. Насилов первый разработал на трупах оперативный доступ к грудному отделу пищевода. Он предложил после резекции нескольких ребер в паравертебральной области отслаивать плевру и внеплеврально резецировать пищевод. Известный французский хирург Gosset в 1903 г. писал: «...с тех пор, когда русский хирург Иван Насилов первый выдвинул идею проникновения в заднее средостение, чтобы подойти к грудному отделу пищевода, медиастинальная хирургия не прекращает прогрессировать». Хирургические методы лечения болезней пищевода продолжали развиваться в Томске и после И. И. Насилова В. Д. Добромысловым (в клинике Э. Г. Салище-•ва), который в 1900 г. опубликовал работу по экспериментальному изучению чресплеврального доступа к пищеводу. Этот доступ и в наше время является общепризнанным при хирургическом лечении рака пищевода. Успех, которого достиг В. Д. Добромыслов в эксперименте, повел за собой ряд отечественных и зарубежных хирургов к попыткам операций в клинике, однако в то время они не увенчались успехом (А. А. Шатилов, Sauerbruch, Biondie, Gosset, Mikulicz я др.).
Неудачи, сопровождавшие чресплевральные операции на пищеводе с попыткой восстановить одномоментно непрерывность желудочно-кишечного тракта путем соединения резецированных концов пищевода, или путем соединения пищевода с кишкой или желудком, заставили Torek ограничиться после резекции пищевода выведением конца его на кожу и наложением гастростомы для питания. В 1913 г. автор произвел первую успешную операцию, после которой больная жила много лет. В дальнейшем эпизодически проводились различные операции
на пищеводе, но они давали много неудовлетворительных исходов. Только с 30—40-х годов хирургия рака пищевода стала медленно входить в практику. К этому времени К. П. Сапожков (1946) и А. Г. Савиных (1947) разработали доступ к грудному отделу пищевода со стороны брюшной полости путем рас-
-сечештя диафрагмы и пересечения диафрагмальных ножек. Большой вклад в хирургию рака пищевода внесли Б. В. Петровский, В. И. Казанский, Е. Л. Березов и др.
При оценке показаний к операции необходимо учитывать локализацию, распространенность опухоли и общее состояние больного. Операции на пищеводе — самые сложные вмешательства с высокой степенью риска, поэтому пожилые больные
•с сопутствующими заболеваниями, особенно сердечно-сосудистой и дыхательной системы, плохо переносят их.
Операции необходимо выполнять под интубационным наркозом.
Хирургическая тактика различна в зависимости от уровня поражения пищевода.
При раке брюшного и нижнегрудного отделов пищевода показана одномоментная чресплевральная резекция пищевода и кар-дии с наложением внутригрудного пищеводно-желудочного анастомоза под дугой аорты. Из онкологических соображений, кроме резекции пищевода на значительном протяжении от опухоли, следует резецировать малую кривизну желудка с прилегающими к ней связками и лимфатическими узлами. Коллективный опыт хирургов показывает, что одномоментное удаление грудного отдела пищевода по поводу рака среднегрудного отдела пищевода с наложением пищеводно-желудочного анастомоза под куполом плевры дает высокую послеоперационную летальность — до 40—50% и выше (Б. А. Петров, 1955; Rosano, 1957;
Tanner, 1961), поэтому большинство хирургов перешли к операциям, с которых в начале XX столетия стала развиваться хирургия пищевода. Речь идет о двухэтапных операциях, которые приходится выполнять и при раке нижнегрудного отдела пищевода, а также, когда в процессе операции убеждаются в невозможности наложения анастомоза под дугой аорты без нарушения принципов абластики.
При раке шейного отдела пищевода резекция с замещением пищевода кишкой чрезвычайно рискованна, в связи с чем лучевые методы лечения более показаны.
Резектабельность устанавливается после рассечения медиа-стинальной плевры и попытки выделить пищевод. Врастание опухоли в бронх, сосуды, позвоночник и трахею, а также наличие метастазов в параэзофагальные лимфатические узлы и обсеменение плевры делают операцию бессмысленной. Врастание опухоли в противоположный плевральный листок, перикард или диафрагму в некоторых случаях не является противопоказанием к резекции.
Больные нуждаются в тщательной предоперационной подготовке. Прежде всего необходима психологическая подготовка. Не всегда легко убедить больного в необходимости двухэтапной операции и существования с желудочным и пищеводным свищами. Большое внимание следует уделять ликвидации белкового и водного дефицита, который особенно выражен при продолжительной дисфагип. Питание должно состоять из тщательно механически переработанных продуктов с большим содержанием белков и витаминов. Многие больные нуждаются во введении электролитов, раствора глюкозы, плазмы. Соответствующая подготовка — основа профилактики наиболее частых легочных и сердечных осложнений. Приходится учитывать, что большинство больных страдает сопутствующими заболеваниями, свойственными людям преклонного возраста и требующими самостоятельного лечения. Необходимо вводить большие дозы витаминов (витамин С до 150—200 мкг в сутки, комплекс витаминов В до 100 мкг в сутки). За несколько дней до операции следует давать пить 3—4 раза в день слабый раствор соляной кислоты или перманганата калия для снижения гнилостных процессов в пищеводе. Особое внимание следует уделять дыхательной гимнастике, ингаляциям с содой и отказу от курения. Перед операцией должна быть проведена санация полости рта. Истощенным и слабым больным целесообразно проводить парентеральное питание (А. В. Суджав, 1974). Тщательная подготовка позволяет расширить операбельность и с успехом выполнять резекцию в пожилом возрасте при отягощенном анамнезо (стенокардия, инфаркт миокарда, эмфизема легких, атеросклероз и т. п.).
Для резекции нижнегрудного отдела пищевода по поводу рака торакотомия производится в шестом межреберье слева.
Для большего раскрытия межреберья и щажения межреберной артерии рекомендуется межреберные мышцы от V ребра в задних отделах отслаивать тупо до щепки. В большинстве случаев при разведении ранорасширителем ребер хрящевую часть реберной дуги целесообразно предварительно рассечь. После рассечения медаастпнальной плевры мобилизуют пищевод с опухолью. Подозрительные на метастазы лимфатические узлы подвергают срочному 'гистологическому исследованию. Дпаф-рагмотомию производят от пищеводного отверстия диафрагмы до переднего угла раны грудной Стенки. Обследуют* брюшную полость. Паракарднальные метастазы не служат противопоказанием к резекции пищевода, по при наличии метастазов в отдаленные органы и лимфатические узлы резекция нецелесообразна. Мобилизацию желудка производят с учетом сохранения кровообращения за счет правой желудочно-сальпикопой артерии. По малой кривизне удаляют все связки и на 3—4 см кверху от привратника резецируют малую кривизну с таким расчетом, чтобы из большой кривизны создать трубку диаметром 4—5 см и достаточной длины для проведения ее к пищеводу и наложения анастомоза без натяжения. Если нет угрозы натяжения анастомоза, целесообразно резецировать и фундальную часть желудка, поскольку после мобилизации эта область недостаточно кровоснабжается. Большую, широкую культю желудка оставлять не нужно, так как это способствует возникновению расстройств эвакуации и пилороспазма. Наиболее удобно культю формировать путем прошивания стенок желудка аппаратом УКЛ в несколько приемов. Поверх танталовых швов накладывают узловые серо-серозные шелковые швы.
Пищевод пересекают выше верхнего края прощупываемой опухоли желательно на 10 см (минимум на 5—6 см). Если опухоль растет инфильтративно, то показана операция Добро-мыслова—Торека. В большинстве случаев пищеводно-желудоч-яый анастомоз приходится накладывать выше нижней легочной вены под дугой аорты. Анастомоз между культей желудка и пищеводом можно осуществлять одним из известных способов. •За последние годы мы предпочитаем инвагинационный анастомоз по методу Березкина—Цацаниди.
Операция Добром ы слова—Торека. Большинство хирургов предпочитают начинать операцию с лапаротомии и наложения гастростомы, хотя сам Torek начинал с торако-томии. Лапаротомия, предшествующая торакотомии, дает возможность ревизовать органы брюшной полости и при обнаружении метастазов отказаться от травматичного вмешательства в грудной полости. Метастазы по малой кривизне желудка и в области кардии при раке среднегрудного отдела пищевода делают операцию малоперспективной, так как эти метастазы уже являются отдаленными. После ревизии брюшной полости и наложения гастростомы больного укладывают на левый бок и производят торакотомию в шестом межреберье. После выделения пищевода с опухолью его пересекают как можно ниже над диафрагмой. Сначала циркулярно пересекают мышечную оболочку, а слизистую оболочку прошивают аппаратом УКЛ, поверх металлических швов накладывают узловые шелковые швы. Верхний конец пищевода над опухолью'также целесообразно прощить аппаратом УКЛ, после чего препарат удаляют, проводить пищевод с опухолью на шею для образования эзофа-гостомы не^ рекомендуется. Средостение и плевральную полость дренируют, легкие расправляют, плевральную полость зашивают наглухо. Больного переворачивают па спину и накладывают эзофагостому.
Операция Добромыслова—Торека дает меньший процент летальности и в связи с удалением всего пищевода более радикальна.
Когда выполнение операции чересплевральпым доступом из-за тяжелых сопутствующих заболеваний опасно, в редких случаях можно применить брюшно-шейный доступ А. Г. Сави-
ных и В. С. Рогачева (1959). Этот доступ показан только при 1 и II стадиях рака, когда опухоль не выходит за пределы мышечного слоя. Эту операцию легче выполнить у людей брахиморфного типа, она требует специальных длинных инструментов (зеркал, пинцетов, ножниц, лопаточек), позволяющих манипулировать в глубокой ране. Операция начинается с лапа-ротомии, широкого рассечения диафрагмы, выделения пищевода до бифуркации трахеи снизу. Через разрез на шее еле h.i выделяют верхнюю половину грудного отдела пищевода и удаляют пищевод. Накладывают гастростому и эзофагостому. К одномоментной пластике пищевода тонкой кишки в заднем средостении после брюшно-шейной экстирпации пищевода следует прибегать только в исключительных случаях, так как длительность операции увеличивается на несколько часов и риск ее возрастает. Больных, которые могут перенести такую операцию одномоментно, следует оперировать более простым чрес-плевральным способом. Широкого распространения эта операция не имеет, так как она сложнее операции Добромыслова— Торека. М. Е. Тюхтев (1973) подверг анализу 185 операций Добромыслова—Терека и выявил, что послеоперационная летальность составляет 17,2%, а пятилетняя выживаемость средч лиц, перенесших операцию,—23,7%. У 33,5% больных после операции Добромыслова—Терека удалось выполнить пластическую операцию создания искусственного пищевода.
Ко второму этапу — пластике пищевода следует приступать через 1—2 мес после экстирпации пищевода, если она прошла без осложнений и выполнена радикально. В противном случае вопрос о второй операции следует ставить через несколько месяцев, убедившись в отсутствии рецидивов и метастазов при хорошем состоянии больного. Такая тактика вызвана тем, что многие больные после удаления пищевода по поводу рака живут менее года. По данным Fekete, Lortat-Jacob (1962), из 36-i больных, перенесших радикальную операцию, 50% жили не более 1 года. Таких больных не следует подвергать сложной пластической операции, поскольку нет перспектив на хорошие отдаленные результаты.
Относительно методов пластики пищевода при раке нет единой точки зрения. Существует много методов, но какой из них дает лучшие результаты, сказать трудно. Отсутствуют работы, которые основываются на большом числе операций с убедительными отдаленными наблюдениями по сравнительной оценке разных операций в одних руках. Каждый хирург осваивает какой-либо метод и отстаивает его. Сравнивать же результаты операций, проведенных разными хирургами, весьма трудно.
Наибольшее распространение получили методы, в которых используются толстая и тонкая кишки, реже—желудок. В СССР равноценным признанием пользуются методы пластики толстой или тонкой кишкой. Благодаря классическим работам С. С. Юдина пластика тонкой кишкой детально разработана, и не удивительно, что она широко применяется отечественными специалистами.
Заслуживает большого внимания пластика пищевода толстой кишкой (П. II. Андросов, 1963; В. II. Попов, 1965).
Предложены различные пути проведения кишки. Наиболее распространено проведение ее в переднем средостении (по Н. II. Еремееву) ц предгрудинно под кожей. Каждый из этих методов имеет свои преимущества и недостатки, освещенные в специальной литературе, но лучшим в каждом случае является тот, которым более уверенно владеет хирург. Успех пластики пищевода зависит от выполнения многих деталей операции. Основным в них является правильная мобилизация кишки, обеспечивающая достаточное кровоснабжение трансплантата. Кишка, заменяющая пищевод, не должна иметь перегибов прежде всего в месте анастомоза ее с желудком, особенно при антиперистальтическом положении кишки. На шее кишку нужпо соединить не с пищеводом, плохо снабжаемым кровью и травмированным при первой операции, а с глоткой; это значительно уменьшает процент недостаточности швов.
При неоперабельной опухоли п резко выраженной дисфагпи может встать вопрос о паллиативной операции — гастростомии по одному из известных методов.
Некоторые хирурги вновь стали применять операцию Сутара, заключающуюся в интубации пищевода для питания больного. Эту операцию осуществляют путем торакотомии, вводя пластмассовую трубку через рассеченный пищевод. В других случаях гыполляют лапаротомию и гастротомию. Воронкообразную трубку вводят через рот по проводнику, введенному в желудок. В последние годы такие паллиативные операции, распространенные за рубежом, применяются реже в связи с тем, что они дают немало осложнений п не улучшают результаты,
При одномоментных и двухэтапных операциях наиболее частым осложнением является сердечно-легочная недостаточность. Лечебные мероприятия в послеоперационном периоде зависят от типа выполненной операции. При одноэтапных операциях с наложением впутригрудного анастомоза послеоперационный период может осложниться несостоятельностью швов анастомоза. Профилактика этого осложнения заключается в правильном формировании соустья.
Большое значение в послеоперационном периоде следует придавать контролю периферической крови, так как тяжелые осложнения со стороны средостения и плевральной полости еще до появления клинической симптоматики дают соответствующие изменения крови.
Если на 3—4—5-й день после операции не уменьшается лейкоцитоз, остается сдвиг лейкоцитарной формулы влево и не появляются эозинофилы — признаки, характеризующие тяжелое
состояние вследствие операционной травмы, следует думать о начинаю., цемся осложнении, чаще всего со стороны средостения. При нормальном течении послеоперационного периода на 4-й день больному разрешают пить и начинают кормить его жидкой обволакивающей пищей (яйцо, масло, соки, кисели) с о-го дня. Для профилактики легочных осложнений нужны дыхательная гимнастика с первых дней после операции, ингаляции с содой для лучшего отхаркивания мокроты.
После операций Добромыслова—Терека могут быть тяжелые нарушения со стороны сердечно-сосудистой деятельности, обусловленные обширной травматической операцией на брюшпой и грудной полостях. Основная тяжесть состояния обусловлена рассечением на всем протяжении заднего средостения, травма-тизацией крупных нервных стволов и сосудов.
Основным средством профилактики послеоперационных сердечно-сосудистых и легочных осложнений является активное обезболивание в первые 3—4 дня. Снять боль в ране можно различными методами, начиная от наркоза закисью азота и кончая медикаментозными средствами. Максимальный успех дает длительная перидуральная анестезия (3. В. Павлова, 1975), которая надежно снимает боли в ране и обеспечивает активное ведение послеоперационного периода.
После паллиативных операций больные должны находиться под наблюдением врача и получать симптоматическое лечение. При наличии воспалительных явлений назначают антибиотики.
Уход за гастростомой
Снижению гнилостных явлений помогает прием 0,1% раствора перманганата калия (по чайной ложке 2—3 раза в день) или соляной кислоты (чайная ложка 10% раствора на V4 стакана воды 3 раза в день). При возникновении болей, связанных с прорастанием соседних органов, применяют наркотики. Раздраженную и мацерировапную кожу вокруг гастростомы следует смазывать индифферентной мазью и присыпать толстым слоем гипса. Желательно, чтобы больной пережевывал пищу и вводил ее через воронку в желудок. В этих случаях включается в пищеварение важный акт — обработка пищи в ротовой полости, больной ощущает ее вкусовые качества и активнее протекают пищевые рефлексы.
После радикального хирургического лечения больные нуждаются в систематическом наблюдении, особенно в течение первого года. После операции Добромыслова—Терека остаются два свища, за которыми нужен уход. После резекции пищевода с одномоментным внутригрудным анастомозом иногда наблюдается длительный пилороспазм, ряд расстройств, связанных с пересечением блуждающих нервов, и эзофагиты. Первые месяцы после загрудинной или предгрудинпой пластики пищевода могут наблюдаться затруднения прохождения пищи по искусственному пищеводу. Таким больным следует рекомендовать измельченную пищу и антиспастические средства. Основная масса
больных, благополучно перенесших резекцию пищевода с одномоментным наложением иищеводно-желудочного внутрпплев-рального анастомоза пли пластику пищевода кишкой, чувствуют себя хорошо и в ряде случаев вполне трудоспособны.
Лучевое лечение. В прошлом делались попытки использовать ионизирующее излучение для лечения рака пищевода. Иногда они оказывались обнадеживающими: снимались боли,.улучшалась проходимость пищевода, некоторым больным удавалось продлить жизнь. Однако вплоть до 40-х годов это были ампирические искания. Только с развитием радиобиологии, физики ионизирующих излучений, дозиметрии, новых источников излучения и технических средств появились научные обоснования лучевой терапии.
В настоящее время лучевое лечение широко применяется для радикальной и паллиативной терапии рака пищевода. Используются рентгеновское излучение, гамма-излучение Сs или Со, тормозное излучение и быстрые электроны. Весьма обнадеживающие результаты получены при облучении плотпоиопизи-рующими ядерными частицами.
Методы подведения излучения к патологическому очагу зависят от энергии излучения и аппаратуры, имеющейся в распоряжении врача. Применяются разные варианты дистанционного статического пли подвижного облучения источниками указанных выше излучений. Cs, Co и Ra используют, кроме того, и для внутрнполостного облучения.
В общем плане задача облучения сводится к созданию в заданном объекте грудной полости — в области средостения — цозного максимума, имеющего форму кругового цилиндра с поперечным диаметром 4—6 см и длиной избирательно в пределах 10—18 см. При этом дозный максимум должен включать всю опухоль и в пределах 3—5 см по обе стороны видимых ее границ как бы здоровую степку пищевода — возможные участки внутристеночиого распространения раковых клеток, а также региопарпые околопищеводные лимфатические узлы. Оптимальная поглощенная доза в очаге, при которой наблюдается полная резорбция опухоли пищевода, составляет 6000—7000 рад. при облучении о раз в педелю и разовой очаговой дозе 150— 200 рад ; (если облучение осуществляется через решетку, дозы-соответственно увеличиваются).
При статическом облучении кожные поля располагаются по периметру грудной клетки (максимально возможное количество полей: 18—22 при рентгенотерапии, 3—4 при гамма-терапии, 1—2 при использовании излучений высоких энергий). При подвижном облучении ротация проводится в пределах 180— 360°.' Следует иметь в виду наметившуюся в последнее время тенденцию к повышению разовых доз излучения и удлинению интервалов между сеансами.
Внутриполостное облучение осуществляется путем введения радиоактивных препаратов в специальном зонде в просвет пищевода. Зонд соответственно месту нахождения радиоактивных препаратов имеет резиновый цилиндрический баллон. При раздувании баллона воздухом радиоактивные препараты занимают в нем центральное положение и, располагаясь таким образом на некотором расстоянии от поверхности опухоли, обеспечивают относительно гомогенное ее облучение. Положение радиоактивных препаратов в пищеводе контролируется просвечиванием в рентгеновском кабинете. Длительность каждой такой внутриполостной аппликации, повторяющейся через 1—2 дня, в зависимости от мощности дозы составляет обычно 2—5 ч. Разовая поглощенная доза в опухоли 175—250 рад, суммарная очаговая доза — 6000—8000 рад. Практика показала, что больные зачастую трудно переносят полный курс внутриполостного облучения. Кроме того, на лучевое лечение часто поступают больные с наличием периэзофагальной инфильтрации. С учетом этих обстоятельств целесообразно сочетанное применение внутриполостного и наружного облучений. Следует подчеркнуть, что при сочетанной лучевой терапии имеет место более оптимальное дозное распределение поглощенного излучения, чем в отдельности при каждом из используемых вариантов облучения. Достоинством сочетания является также уменьшение интегральных доз по сравнению с одним наружным облучением.
Возможны различные сочетания внутриполостного и наружного облучения. При достаточной ширине просвета суженного опухолью пищевода вначале можно проводить внутриполостное облучение. При резко суженном просвете сочетанную лучевую терапию следует начинать с наружного облучения.
Называя оптимальные поглощенные дозы, следует помнить, что большие дозы повышают местный эффект лучевой терапии, однако соответственно увеличивается частота и тяжесть осложнений. Иногда до начала лучевой терапии, если больной плохо глотает даже жидкую пищу, приходится накладывать гастро-ctomv, которую можно снять после эффективного лечения. Однако с гастростомой, по нашему мнению, спешить не следует, так как почти всегда после 10—15 сеансов облучения проходимость пищевода улучшается и больные начинают удовлетворительно питаться. С другой стороны, ранняя гастростомия целесообразна потому, что она позволяет визуально и пальпаторно оценить состояние поддиафрагмальных лимфатических узлов и печени,.а затем обоснованно выбирать радикальное или паллиативное
.лечение.
Если предварительно была произведена реканализация пищевода, уменьшение размеров опухоли под влиянием лучевого воздействия создает условия для «проскакиванпя» в желудок пищеводного протеза, который затем отходит с каловыми массами.
Во время лучевого лечения вазначают высококалорий-яую пищу, богатую протеинами и витаминами. Пища должна быть теплой, жидкой или полужидкой копснстеп-зции («трубочный» стол) и приниматься часто, мелкими порциями.
Практика выбора метода леченпя, наиболее целесообразного у конкретного больного, показала, что при опухолях, растущих главным образом в просвет пищевода, следует оперировать боль-заых, а при опухолях, растущих кнаружи, отдавать предпочтение лучевой терапии.(рис. 50, 51). При этом должны быть приняты во внимание стадия и другие особенности заболевания, а также
-состояние больного.
При выборе метода лечения следует учитывать возможности каждого метода лечения (хирургического пли лучевого) или их комбинации. В этом отношении взаимопонимание и совместная деятельность хирурга и лучевого терапевта имеют первостепенное значение.
Показанием к радикальной лучевой терапии при раке пищевода служат:
1) достоверный диагноз злокачественной опухоли;
2) отсутствие отдаленных метастазов;
3) ограниченная протяженность поражения;
4) удовлетворительное общее состояние больного и показателей темопоэза.
Принципиально следует учесть, что паллиативное лучевое лечение возможно v
большинства больных раком пищевода, за исключением тех,. у которых имеются перфорация опухоли и отдаленные метастазы, а также выражена кахексия. Применение лучевой терапии в этих случаях неизбежно влечет за собой ухудшение состояния.
Наличие метастазов, появляющихся рано в регионарных лимфатических узлах первого порядка (на стенках пищевода'), но служит препятствием к радикальному лучевому лечению. Метастазы в лимфатические узлы второго порядка (в средостении и корнях легких) также не исключают возможность радикальной лучевой терапии. Метастазы опухоли в отдаленные лимфатические узлы (надключичные, шейные, подмышечные и т. д.) и органы (печень и др.) делают радикальное лучевое лечение нецелесообразным.
Туберкулез легких в активной форме обычно служит препятствием к лучевому лечению рака пищевода. В таких случаях вслед за массивным облучением наступает генерализация или
обострение туберкулезного процесса. Однако в некоторых случаях может быть произведена попытка лечения этих больных па фоне специфической противотуберкулезной терапии.
Обезвоженных, слабых и истощенных больных следует готовить к лучевой терапии дробными переливаниями небольших количеств крови, введением растворов электролитов. Вместе с тем следует иметь в виду, что даже паллиативное лечение таких больных редко оказывается успешным.
Нарушение сердечной деятельности и функции почек, гипертоническая болезнь, а также диабет ограничивают, но не исключают возможности лучевой терапии при раке пищевода. Требуются лишь строгая индивидуализация лечения (уменьшение общих и разовых доз, удлинение интервалов между сеансами и т. д.) и тщательный контроль за сердечной деятельностью и общим состоянием.
Острые воспалительные процессы и изменения со стороны крови (резко выраженная аномпя. лейко- н днмфопелия) могут затруднить применение лучевого лечения. Именно в таких случаях особое значение приобретает сочетание различных терапевтических мероприятий.
Раннее обращение больного, небольшие местные изменения, общее удовлетворительное состояние, отсутствие выраженных легочпо-сердечных изменении, наличие нормальных кожных покровов прп хорошей реактивности организма дают все основания к радикальному лучевому лечению.
Цель паллиативной лучевой тораппп — апалъгетпческнй эффект, устранение функциональных нарушений, обусловленных опухолью, продолжение жизни и сохранение работоспособности. Особо следует помнить, что облучение с паллиативной целью показано после неудачной попытки радикального хпрургп-ческго лечения — пробной торактомомпи. Проследуя паллнатпв-Бые цели, можно попытаться облучать наряду с первичной опухолью и солнтарпые метастазы (надключичные, легочные п др.). Однако необходимо помнить, что для получения необходимого эффекта поглощенная доза должна достигать 5000— 6000 рад за 5—6 пед. Это технически трудно выполнить. Результаты паллиативного лечения в отдельных случаях могут быть сравнимы с результатами радикального облучения.
При выборе метода лечепия существенное значение имеет.локализация опухоли в пищеводе.
Опыт показал, что при раке нижней третей пищевода методом выбора является оперативное вмешательство, тогда как при раке средней трети — лучевое лечение.
На эффективность лучевого лечения существенно могут влиять примененная методика п техника облучения. Выбор наиболее подходящих условий облучения должен быть обязательно связан с одновременным применением комплекса меропрпятий, направленных на повышение реактивности больного и профилактику сопутствующих облучению реакций организма.
Подобно тому как при хирургическом лечении операция сама по себе не может обеспечить лечебный успех и ведение предоперационного и послеоперационного периодов является существенным условием хорошего исхода, при лучевой терапии пред-и послелучевоп периоды имеют немаловажное значение. Однако к этим двум периодам при лучевом лечении присоединяется довольно длительный (около 2 мес) «лучевой период». Именно в этом периоде процессы выздоровления особенно сложны, разнообразны и весьма индивидуальны. Они зависят от многих факторов, в том числе от сопутствующих лечебных мероприятий, от умения применять их на пользу больного.
Лучевому лечению предшествует ряд подготовительных мероприятий: 1) составление плана основного (лучевого) и дополнительного лечения; 2) снятие «поперечного среза» грудной клетки на уровне середины опухоли; 3) нанесение на срез схемы расположения внутренних органов, выбор кожных полей или зон облучения, а также ориентиров для центрации рабочих пучков излучения; 4) определение расстояний (источник излучения — кожа, опухоль) или радиуса л угла качания, размеров щели диафрагмы и других технических параметров; 5) дозиметрический расчет лучевой нагрузки на органы и ткани грудной клетки — составление карт дозного поля при заданной поглощенной дозе в очаге; 6) перенесение на кожу меток входа и выхода центрального рабочего пучка излучения — ориентиров, обеспечивающих точность наводки рабочих пучков излучения на опухоль. Иногда на кожу наносят и контуры входных полей.
Укладка больного и ориентация рабочего пучка излучения в отношении опухоли, осуществляемая по кожным меткам, контролируются рнтгеноскопией, рентгено- пли гаммаграфией. Для этого пищевод контрастируется взвесью сульфата бария.
Лучевой терапии рака пищевода сопутствуют лучевые реакции со стороны окружающих здоровых тканей и органов, а также всего организма.
Могут возникнуть ларингит, трахеит, эзофагит, пульмонит, дерматит, лимфо- и лейкопения, явления интоксикации, нарушения функции нервной и эндокринной систем, обмена веществ.
В конечном счете в тканях, локализующихся в области значительных поглощенных доз излучения, развиваются фиброзные изменения, которые иногда могут давать «малую» клинику (легкие и др.) или даже протекать бессимптомно (сердце). Клинические наблюдения показали, что доза на спинной мозг не должна превышать 4500 рад за 4—5 нед; толерантность органов и тканей, окружающих брюшной отдел пищевода, значительно меньше, чем нормальных тканей шеи и средостения; эзофагит появляется после подведения к пищеводу в среднем 3000 рад за 3 нед.
Особо следует сказать об опасности перфорации опухоли в соседние органы или сосуды средостения во время или после курса лучевого лечения. При больших опухолях, когда мышечный слой стенки пищевода и слизистая оболочка разрушаются, такой исход весьма вероятен как результат несоответствия темпа регрессии опухоли и регенераторпо-восстановительных процессов здоровых тканей.
Степень выраженности лучевых реакций весьма непостоянна. Реакции не всегда адекватны энергии излучения, варианту облучения п дозам, несмотря на то, что эти факторы несомненно играют роль в объеме и выраженности реакции. Осложняющие лучевую терапию явления хотя и представляют в клиническом отношении ряд особенностей, однако лечение их проводится по общим правилам. Следует иметь в виду, что после перенесенных лучевых реакций организм никогда не возвращается к исходному состоянию. Именно это обстоятельство делает весьма трудным п малоперспективным повторную лучевую терапию при рецидивах опухоли пищевода. Во всяком случае она должна предприниматься не раньше, чем через 6 мес после окончания первого курса, и при условии отсутствия значительных после-лучевых повреждений.
И. А. Переслегин и А. И. Барканова (1965) непосредственно после статической и ротационной гамма-терапии и рентгенотерапии через решетку у 179 больных раком пищевода зарегистрировали следующие результаты: полное исчезновение опухоли — у 15%, значительное уменьшение — у 27%, уменьшение— у 49%, прежние размеры — у 7%, увеличение опухоли — у 2% больных.
И. Л. Гусева (1967), используя подвижную гамма-терапию "'^Cs, достигла клинического излечения у 40% больных, паллиативного успеха—у 56,8%, лечение было неэффективным у 3,2% больных. При сочетанной дистанционной и внутриполост-адой гамма-терапии ^Со Т. П. Евстигнеева и 3. Ф. Лопатпикова (1961) получили следующие непосредственные результаты: значительное улучшение — у 51%, улучшение—у 45%, без изменений — у 3 % больных.
Результаты лучевой терапии рака пищевода 1000 больных (после статического или подвижного облучения, излучения различных энергий и при разных локализациях опухоли), опубликованные А. И. Рудерманом в 1968 г., следующие: клиническое излечение — у 35% больных, паллиативный эффект — у 39%, неэффективность лечения—у 26%. Эти данные мало изменились за последние годы. Под «клиническим излечением» понималось исчезновение клинических симптомов и рентгенологических. признаков рака пищевода, а под «паллиативным эффектом» — сохранение жалоб или рентгенологических изменений, подозрительных на частичное сохранение злокачественной опухоли.
Локализация опухоли в пищеводе сказывается на результатах лучевой терапии. Наилучший эффект наблюдается при раке грудного отдела пищевода. При раке шейного и брюшного отделов результаты менее благоприятные.
Отдаленные результаты лучевой терапии больных раком пищевода, отнесенных А. II. Рудерманом (1968) в группу «клинически излеченных», были следующие: более 2 лет жили 28% больных, 3 лет— 16%, 4 лет — 6%, 5 лет — 4%. По данным Г. А. Зедгенпдзе, после статической рентгенотерапии более-2 лет жили 41% больных, а после статической гамма-терапии— 55%, более 3 лет—3% и 5 лет— 1%. По нашим наблюдениям в ОНЦ АМН СССР (1973) после гамма-терапии прожили 1 год—47,1%, 3 года— 14,6%, 5 лет—4,7% больных. По данным Kuttiiig и Wcitzel после лучевой терапии свыше о лет жили 1,6 % больных, Nielseu — 4,2 %, Gunning — 5,2 %, Poschi — 4%, Diethcleni — 7,4%, Schorer — 1,7% больных.
Высоко оценивая эффективность лучевой терапии рака пищевода, ошибочно во всех случаях отождествлять видимое исчезновение опухоли с излечением.
» Изучение патогенеза больных, окончивших курс лучевой терапии с оценкой «клиническое излечение», показало, что примерно 35% из них умирают от метастазов, 35% —от рецидива опухоли, а 30% — от причин, не связанных со злокачественным процессом (А. И. Рудермап). Последняя группа включает н больных, причина смерти которых может быть связана с луче-г.ымп повреждениями. Метастазы после лучевой терапии (если. объем дозного максимума выбран правильно) обычно появляются вне облученного средостения. Иногда они выявляются:
во время курса лечения, что указывает на наступившую генерализацию процесса. В этих случаях лучевая терапия соответственно должна быть сведена
Date: 2015-10-19; view: 634; Нарушение авторских прав