
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Диссоциация воды
|
|
Химически чистая вода обладает хотя и ничтожной, но измеримой электропроводностью, так как вода в незначительной степени диссоциирует на ионы. Так при комнатной температуре лишь примерно одна из 108 молекул воды находится в диссоциированной форме. Процесс электролитической диссоциации воды возможен благодаря достаточно высокой полярности связей О-Н и наличию между молекулами воды системы водородных связей. Уравнение диссоциации воды записывается так:
2H2O ↔ H3O+ + OH- ,
где H3O+ - катион гидроксония водорода.
Уравнение диссоциации воды можно записать в более простой форме:
H2O ↔ H+ + OH- .
Присутствие в воде ионов водорода и гидроксида придают ей специфические свойства амфолита, т.е. способность выполнять функции слабой кислоты и слабого основания. Константа диссоциации воды при температуре 220С:
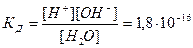 , (1)
, (1)
где [H+] и [OH-] – равновесные концентрации в г-ион/л соответственно катионов водорода и гидроксо-анионов, а [H2O] – равновесная концентрация воды в моль/л. Учитывая, что степень диссоциации воды чрезвычайно мала, равновесную концентрацию недиссоциированных молекул воды вполне можно приравнять к общему количеству воды, заключающемуся в 1 л ее:
 . (2)
. (2)
Теперь выражение (1) можно записать в следующем виде:
 , (3)
, (3)
отсюда [H+] [OH-] = (1,8 10-16) 55,56 = 10-14 г-ион2/л2.
Произведение концентраций ионов водорода и гидроксо-ионов является константой не только для воды, но и для водных растворов солей, кислот и щелочей. Эта величина называется ионным произведением воды или константой воды. Следовательно: КН2О = [H+][OH-] = 10-14 г-ион2/л2.
Для нейтральных сред [H+] = [OH-] = 10-7 г-ион/л. В кислых средах [H+] > [OH-], а в щелочных [H+] < [OH-]. При этом в любых средах произведение концентраций ионов водорода и гидроксо-ионов при данной температуре остается постоянным и равным 10-14 г-ион2/л2. Таким образом, пользуясь ионным произведением воды, любую реакцию среды (нейтральную, кислую или щелочную) можно количественно выразить при помощи концентрации водородных ионов.
1.2. Водородный показатель – рН
Для количественной характеристики реакции среды обычно приводят не концентрации водородных ионов, а применяют некоторый условный показатель, обозначаемый через рН и называемый водородным показателем. Он представляет собой отрицательный десятичный логарифм концентрации катионов водорода рН = - lg [H+].
Для нейтральной среды рН = -lg 10 -7 = 7;
для кислотной - рН < 7;
для щелочной - рН >7.
Аналогично вводится понятие гидроксильного показателя рОН = - lg [ОH-].
рН + рОН = 14.
Определение рН имеет колоссальное значение в технике и, в частности, в строительном деле. Обычно величину рН измеряют при помощи индикаторов - веществ, способных менять свою окраску в зависимости от концентрации ионов водорода. Индикаторами являются слабые кислоты и основания, молекулы и ионы которых окрашены в разный цвет (табл. 1).
Таблица 1
| Индикаторы | Реакция среды раствора | ||
| Кислая рН < 7 | Нейтральная рН = 7 | Щелочная рН > 7 | |
| Лакмус | Красный | Синий | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Розовый | Оранжевый | Желтый |
Однако индикаторы дают не точное определение значения рН, поэтому современные измерения рН производятся при использовании электрохимических методов, точность которых составляет ±0,01 единицы рН.
Пример 1. Вычислить рН раствора, в котором концентрация ионов ОН- равна 1∙10-9 моль/л.
Решение. Из соотношения рН + рОН = 14 находим, что рН = 14 – рОН. Так как рОН = - lg [ОH-], то рН = 14 – (-lg 10-9) = 5.
Date: 2015-10-19; view: 590; Нарушение авторских прав