
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическое равновесие. Реакции, протекающие только в одном направлении до тех пор, пока не израсходуется одно из реагирующих веществ
|
|
 Реакции, протекающие только в одном направлении до тех пор, пока не израсходуется одно из реагирующих веществ, называются необратимыми. Например, реакция разложения нитрата аммония является необратимой, т.к. попытки получить нитрат аммония при взаимодействии воды и оксида азота (I) не привели к положительному результату: NH4NO3 N2O + 2H2O. Реакции, способные протекать в двух направлениях, называются обратимыми. Обратимых реакций больше, чем необратимых.
Реакции, протекающие только в одном направлении до тех пор, пока не израсходуется одно из реагирующих веществ, называются необратимыми. Например, реакция разложения нитрата аммония является необратимой, т.к. попытки получить нитрат аммония при взаимодействии воды и оксида азота (I) не привели к положительному результату: NH4NO3 N2O + 2H2O. Реакции, способные протекать в двух направлениях, называются обратимыми. Обратимых реакций больше, чем необратимых.

 Примером обратимой реакции может служить процесс взаимодействия йода с водородом: Н2 + J2 2HJ. По мере протекания прямой реакции расходуются исходные реагирующие вещества, и уменьшается скорость прямой реакции, но увеличивается концентрация продукта реакции HJ и, следовательно, увеличивается скорость обратной реакции. Через некоторый промежуток времени скорость образования HJ становится равной скорости его разложения, т.е. наступает химическое равновесие. Химическое равновесие – это динамическое состояние, при котором происходят непрерывное образование и распад молекул с равными скоростями, т.е. V пр. = V обр.
Примером обратимой реакции может служить процесс взаимодействия йода с водородом: Н2 + J2 2HJ. По мере протекания прямой реакции расходуются исходные реагирующие вещества, и уменьшается скорость прямой реакции, но увеличивается концентрация продукта реакции HJ и, следовательно, увеличивается скорость обратной реакции. Через некоторый промежуток времени скорость образования HJ становится равной скорости его разложения, т.е. наступает химическое равновесие. Химическое равновесие – это динамическое состояние, при котором происходят непрерывное образование и распад молекул с равными скоростями, т.е. V пр. = V обр.
В общем виде химическая реакция может быть представлена уравнениями: аА + bB = cC + dD; V пр = k1 [A]a[B]b; V обр. = k2 [С] с[D]d.
Так как при химическом равновесии V пр. = V обр., следовательно k1 [A]a[B]b= k2 [С]с[D]d. Для преобразования делим обе части равенства на выражение k2 [С] с[D]d:  , получаем
, получаем  .
.
Величина Кр как отношение постоянных величин есть величина постоянная, называемая константой равновесия. Концентрации реагентов при установившемся равновесии называются равновесными концентрациями.
Например: 2СO + O2 = 2СO2, 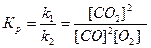 .
.
Концентрации реагирующих веществ не влияют на константу равновесия, так как константы скорости реакций, отношением которых она является, не зависят от концентрации. Но k1 и k2 зависят от температуры и меняются с изменением температуры по-разному, поэтому Кр зависит от температуры.
При неизменных внешних условиях состояние (положение) равновесия сохраняется сколь угодно долго. При изменении внешних условий положение равновесия изменяется, так как нарушается равенство V пр. = V обр. Через некоторое время после изменения условий установится новое равновесие, но при других равновесных концентрациях. Переход системы из одного равновесного состояния в другое называется смещением равновесия (сдвигом равновесия).
Закономерное влияние внешних условий (концентраций реагентов, температуры, давления) на положение равновесия обратимых химических реакций было установлено в 1847 году французским ученым Ле-Шателье. Принцип Ле-Шателье звучит следующим образом: “ Если на систему, находящуюся в равновесном состоянии, оказать какое-либо внешние воздействие (изменение температуры, давления, концентрации), то равновесие в системе сместиться в сторону той реакции, которая сводит это воздействие к минимуму”
1. При увеличении концентрации какого-либо вещества, участвующего в равновесии, равновесие смещается в сторону расхода данного вещества, а при уменьшении концентрации – в сторону его образования.
Например, в системе 2СO + O2 = 2СO2 при увеличении концентрации кислорода равновесие сместится в сторону его расходования, т.е. вправо, в сторону образования СО2.
2. При увеличении давления путем сжатия системы равновесие смещается в сторону меньшего числа молекул газа, т.е. в сторону понижения давления, а при уменьшении давления равновесие сместится в сторону большего числа молекул газа, т.е. в сторону увеличения давления.
Например, в системе 2СO + O2 = 2СO2 при увеличении давления равновесие сместится в сторону меньшего числа молекул газа, т.е. вправо, в сторону образования СО2, так как в левой части три молекулы газа, а в левой всего две. ся в равновесном состоянии, оказать какое-либо внешние воздействие (на положение равновесия обратимых химических реакций был
 Но есть равновесные системы, в которых давление не влияет на смещение равновесия. Например, в системе Н2 + J2 2HJ при изменении давления равновесие смещаться не будет, так как в левой и правой частях находится по две молекулы газа.
Но есть равновесные системы, в которых давление не влияет на смещение равновесия. Например, в системе Н2 + J2 2HJ при изменении давления равновесие смещаться не будет, так как в левой и правой частях находится по две молекулы газа.
3. При увеличении температуры равновесие смещается в направлении эндотермической реакции, а при уменьшении – в направлении экзотермической реакции.
Экзотермической реакций называется реакция, идущая с выделением тепла (ΔН<0), а реакция, идущая с поглощением тепла называется эндотермической (ΔН>0).
 Например: 2Н2 + О2 2Н2О, ΔН = -484,9 кДж.
Например: 2Н2 + О2 2Н2О, ΔН = -484,9 кДж.
При увеличении температуры в данной системе равновесие сместится влево, в сторону исходных реагирующих веществ, так как обратная реакция является эндотермической.
Принцип Ле-Шателье подтверждается и распространяется не только на химические, но и на различные физико-химические равновесные процессы. Смещение равновесия при изменении условий таких процессов, как кипение, кристаллизация и растворение, происходит в соответствии с данным принципом.
Растворы
Растворы имеют огромное значение в минеральной и органической жизни Земли, в науке, технике, строительстве.
Раствор - однородная в фазовом отношении сложная система переменного состава.
 Т в е р д ы е
(минералы, сплавы) Т в е р д ы е
(минералы, сплавы)
| ||
| Растворы | ||

| Ж и д к и е (раствор NaCl в воде) | ||
| Г а з о о б р а з н ы е (воздух – 21 % О2 + 78 % N2 + 1 % др. газов) | ||
Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкость) и растворенного вещества. Например: раствор газа в жидкости – кислород в воде; раствор твердого вещества в жидкости – сахар в воде; раствор жидкости в жидкости – серная кислота в воде. В случае смеси жидкостей растворителем является жидкость, которая содержится в большем количестве. Кроме того, жидкими растворами являются и те, в которых растворитель не вода, а другая жидкость (спирт, ацетон, толуол, керосин и др.).
Способность вещества растворяться всегда ограничена, исключение составляют жидкости, смешивающиеся друг с другом в разных соотношениях, например вода и этиловый спирт. Количество вещества, которое может раствориться при данной температуре в определенном количестве растворителя, называется растворимостью (S). Единицы измерения растворимости г или моль растворенного вещества в 1 дм3 растворителя; г растворенного вещества в 100 г растворителя. Растворимость разных веществ в воде при постоянной температуре различается весьма сильно. Хорошо растворимыми считаются вещества, которые растворяются в воде более 10 г/л. Слабо растворимые – растворяются в воде в диапазоне от 0,01 до 10 г/л. Практически нерастворимые – растворяются в воде менее 0,01 г/л. Раствор, в котором при данной температуре вещество больше растворяться не может, называется насыщенным (С= S, здесь С – концентрация растворенного вещества). Ненасыщенный раствор содержит меньше растворенного вещества, чем насыщенный (С< S) при данной температуре; п е р е с ы щ е н н ы й раствор содержит растворенного вещества больше, чем насыщенный (С > S). Растворимость веществ обычно зависит от температуры. Растворимость большинства твердых и жидких веществ с повышением температуры увеличивается, газообразных - уменьшается.
Растворение - сложный физико-химическийц процесс. С одной стороны, растворяющееся вещество удаляется с поверхности кристалла и равномерно распреде- ляется по объему растворителя - физический процесс (диффузия). Скорость диффузии оказывает значительное влияние на скорость растворения. С другой - частицы растворенного вещества и растворителя взаимодействуют друг с другом - химический процесс (сольватация). Если растворителем является вода, то говорят о гидратации растворенного вещества. Гидратная оболочка довольно прочно связана с частицами растворенного вещества и при его выделении из раствора входит в состав кристаллов.
CuSO4 + H2O ¾¾¾¾¾® синий р-р ¾¾¾¾¾® CuSO4 5H2O
растворение выпаривание
CuSO4 - вещество белого цвета; CuSO4 5H2O – кристаллогидрат меди - вещество синего цвета. Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Помимо наличия кристаллогидратов, доказательством того, что растворение хими- ческий процесс, является тепловой эффект при растворении. Например, если поместить в стакан с водой твердую соль NH4NO3, то в результате растворения последней темпе- ратура раствора понижается так сильно, что стакан примерзает к поверхности,на которой стоит, если она смочена водой; при добавлении H2 SO4 в стакан с водой последний заметно нагревается.
Установлено, что тепло поглощенное при растворении (отрицательный тепловойэффект) затрачивается на разрушение кристаллической решетки и диффузия раство- ряющегося вещества на весь объем раствора (физический
процесс). Причиной положительного теплового эффектаслужит образование сольватов (химический процесс).
Общий тепловой эффект растворения - алгебраическая сумма положительного и отрицательного тепловых эффектов. В зависимости от природы растворяемого вещества соотношение положительного и отрицательного эффектов при растворении меняется и, следовательно, меняются величина и знак суммарного теплового эффекта.
Любой растворитель характеризуется параметрами: давление насыщенного пара, осмотическое давление, температуры кипения и замерзания. Для разбавленных растворов неэлектролитов аналогичные свойства изменяются пропорционально концентрации растворенного вещества и описываются законами Ф. Рауля и Я. Вант-Гоффа.
Date: 2015-10-19; view: 541; Нарушение авторских прав