
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Количественные характеристики гидролиза. Интенсивность протекания процесса гидролиза характеризуется степенью гидролиза β – величиной, показывающей процентное отношение числа гидролизованных
|
|
Интенсивность протекания процесса гидролиза характеризуется степенью гидролиза β – величиной, показывающей процентное отношение числа гидролизованных молекул n к общему числу растворенных молекул N.
 .
.
Степень гидролиза зависит от ряда факторов. Так при разбавлении раствора гидролиз данной соли углубляется, степень гидролиза повышается. Например, в 0,1 н растворе Na2CO3, β = 4,5%, а в 0,001 н растворе 34%.
При повышении температуры раствора степень гидролиза соли сильно возрастает, это связано с тем, что при нагревании степень диссоциации воды повышается. Это усиливает взаимодействие ионов водорода и гидроксо-группы с ионами соли.
С другой стороны, усиление гидролиза при повышении температуры можно объяснить смещением равновесия. Процесс гидролиза является эндотермическим, т.е. протекает с поглощением тепла. Поэтому при увеличение температуры равновесие смещается в сторону продуктов гидролиза.
Гидролиз можно усилить, вводя в раствор соли реактив, связывающий образующиеся при гидролизе ионы H+ и ОН-. При этом, согласно принципу Ле-Шателье, равновесие смещается в сторону продуктов гидролиза, в результате гидролиз может протекать полностью – до образования конечных продуктов.
Ионы H+ и ОН- можно связать в молекулы воды, вводя в раствор щелочь, кислоту или другую соль, гидролиз которой приводит к накоплению в растворе ионов H+ или ОН-. Например, при смешении растворов CrCl3 и Na2CO3, происходит взаимное усиление гидролиза и образование конечных продуктов – осадок Cr(OH)3 и газ CO2:
2CrCl3 + 3Na2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 6NaCl;
2Cr3+ + 3CO32- + 3H2O = 2Cr(OH)3↓ + 3CO2↑.
Еще одной количественной характеристикой процесса гидролиза является константа гидролиза Кг.
Реакцию гидролиза соли МА в общем виде можно представить следующим уравнением:
МА + НОН ↔ МОН + НА.
Тогда константа равновесия этой реакции будет иметь следующий вид:
 .
.
Так как концентрация воды в разбавленных растворах представляет собой практически постоянную величину, то обозначив К[НОН] = Кг, получим:
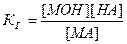 .
.
Значение Кг характеризует способность данной соли подвергаться гидролизу; чем больше значение константы, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз.
Для соли, образованной сильным основанием и слабой кислотой, Кг имеет следующий вид:
 .
.
Заменяя [ОН-] на  , получим:
, получим:
 ,
,
где КНА – константа диссоциации кислоты.
Это уравнение показывает, что константа гидролиза тем больше, чем меньше КНА, т.е. чем слабее кислота, тем в большей степени подвергается гидролизу данная соль.
Для соли, образованной слабым основанием и сильной кислотой, аналогичное соотношение связывает константу гидролиза с константой диссоциации основания КМОН:
 .
.
Поэтому, чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
Для соли, образованной слабым основанием и слабой кислотой, константа гидролиза связана с КНА и КМОН следующим соотношением:
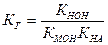 .
.
Окислительно-восстановительные реакции
Окислительно-восстановительными называются реакции, сопровождающиеся изменением степеней окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления (n) понимают тот условный заряд атома, который вычисляется исходя из предположения, что молекула состоит только из ионов. Иными словами: степень окисления – это тот условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное число электронов.
Любая молекула является электронейтральной, поэтому алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю.
Некоторые элементы во всех сложных веществах имеют постоянную степень окисления.
| Элементы с постоянной степенью окисления | Степень окисления |
| а) щелочные металлы (Li, Na, K, Rb, Cs, Fr) | +1 |
| б) элементы II группы (кроме Hg): Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| в) алюминий Al | +3 |
| г) фтор F | -1 |
Водород и кислород в большинстве сложных веществ имеют постоянные степени окисления, но есть исключения:
| Элемент | Степень окисления в большинстве соединений | Исключение |
| Н | +1 | Гидриды основных металлов:
   +1 +1 +2
Na H, K H, Ca H2 и др.
+1 +1 +2
Na H, K H, Ca H2 и др.
|
| О | -2 | Пероксиды водорода и металлов:
   +1 +1 +2
+1 +1 +2
 Н2 О2, Na2 O2, Ca O2 и др.
Фторид кислорода: -1
O F2 Н2 О2, Na2 O2, Ca O2 и др.
Фторид кислорода: -1
O F2
|
Все другие элементы в различных соединениях имеют разные степени окисления, т.е. являются элементами с переменной степенью окисления.
Например, определим степени окисления углерода в различных соединениях. Одновременно напишем графические формулы этих соединений, чтобы показать валентность углерода.
 х +1 Н
х +1 Н
 С Н4 х + 4 (+1) = 0; х = -4 Н – С – Н;
С Н4 х + 4 (+1) = 0; х = -4 Н – С – Н;
Н

 х +1 Н Н
х +1 Н Н

 С2 Н6 2х + 6 (+1) = 0; х = -3 Н – С – С – Н;
С2 Н6 2х + 6 (+1) = 0; х = -3 Н – С – С – Н;
Н Н

 х +1 Н Н
х +1 Н Н

 С2 Н4 2х + 4 (+1) = 0; х = -2 С = С;
С2 Н4 2х + 4 (+1) = 0; х = -2 С = С;
Н Н

 +1 х -2 +1 О
+1 х -2 +1 О
 Н С О Н х + 2 (+1) + (-2) = 0; х = 0 Н – С;
Н С О Н х + 2 (+1) + (-2) = 0; х = 0 Н – С;
Н

 +1 х -2 -2 +1 О
+1 х -2 -2 +1 О
 Н С О О Н х+2(+1)+2(-2)=0; х=+2 Н – С;
Н С О О Н х+2(+1)+2(-2)=0; х=+2 Н – С;
О – Н
х -2
С О2 х+2(-2)=0; х = +4 О = С = О.
Вы видите, что степень окисления углерода изменяется от -4 до +4, а валентность углерода во всех соединениях равна IV.

 Например, в окислительно-восстановительной реакции Н
Например, в окислительно-восстановительной реакции Н  +CI
+CI  =2Н+CI- валентность атомов водорода и хлора до и после реакции равна единице. Изменилась их степень окисления. Валентность определяет число связей, образованных данным атомом, и поэтому знака не имеет. Степень же окисления имеет знак плюс или минус. Степень окисления со знаком плюс говорит о смещении электронной плотности от данной частицы, степень окисления со знаком минус – к данной частице: 02-
=2Н+CI- валентность атомов водорода и хлора до и после реакции равна единице. Изменилась их степень окисления. Валентность определяет число связей, образованных данным атомом, и поэтому знака не имеет. Степень же окисления имеет знак плюс или минус. Степень окисления со знаком плюс говорит о смещении электронной плотности от данной частицы, степень окисления со знаком минус – к данной частице: 02-
Н+ Н+.
Необходимо знать, что:
1. Металлы во всех сложных соединениях имеют только положительные степени окисления.
2. Неметаллы могут иметь и положительные, и отрицательные степени окисления. В соединениях с металлами и водородом степени окисления неметаллов всегда отрицательные.
3. Высшая (максимальная) степень окисления элемента, как правило, равна номеру группы, в которой находится элемент в периодической системе.
4. Низшая (минимальная) степень окисления металлов равна нулю. Низшая степень окисления неметаллов обычно равна: восемь минус номер группы, в которой находится элемент.
5. Значения степеней окисления элемента между высшей и низшей степенями окисления называются промежуточными.
6. Например, элемент-неметалл азот (V группа) может иметь следующие степени окисления:
| Низшая степень окисления | Промежуточные степени окисления | Высшая степень окисления | ||||||
| -3 NH3 | -2 N2H4 | -1 NH2OH | N2 | +1 N2O | +2 NO | +3 N2O3 | +4 NO2 | +5 N2O5. |
Знание степеней окисления элементов позволяет делать выводы о химических свойствах веществ, в состав которых входят эти элементы.
Степени окисления элементов изменяются, потому что при протекании окислительно-восстановительной реакции происходит переход электронов от атомов одного элемента к атомам другого, то есть одни атомы отдают электроны, а другие атомы присоединяют их.
Процесс отдачи электронов называется окислением. Например:
Cu0–2  →Cu+2. При окислении степень окисления элемента повышается.
→Cu+2. При окислении степень окисления элемента повышается.
Процесс присоединения электронов называется восстановлением. Например: Hg+2+2  →Hg0 . При восстановлении степень окисления элемента понижается.
→Hg0 . При восстановлении степень окисления элемента понижается.
Уравнения, которые выражают процессы окисления и восстановления, называются электронными уравнениями.
Окисление всегда сопровождается восстановлением, а восстановление – окислением. Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов: окисления и восстановления (сопряженные процессы).
Восстановителями называются атомы, молекулы или ионы, которые отдают электроны в процессе окисления. Восстановители в процессе реакции окисляются.
Окислителями называются атомы, молекулы или ионы, которые присоединяют электроны в процессе восстановления. Окислители в процессе реакции восстанавливаются.
По окислительно-восстановительным свойствам все вещества можно разделить на три группы:
1. Вещества, которые могут быть только окислителями. В молекулах таких веществ элементы, изменяющие степень окисления, находятся в высшей степени окисления: HNO3, KMnO4, HMnO4, K2Cr2O7, CrO3, PbO2, HBiO3, H2SO4 (конц.).
Частицы с высшими степенями окисления не могут отдавать электроны, а могут только присоединять их.
2. Вещества, которые могут быть только восстановителями. В молекулах таких веществ элементы, изменяющие степень окисления, находятся в низшей степени окисления: NH3, H2S, HF, HCl, HBr, HJ, PH3, гидриды металлов (NaH), Na, Fe, Al, Zn и т.д.
Частицы с низшими степенями окисления не могут присоединять электроны, а могут только отдавать их.
3. Вещества, которые могут быть и окислителями, и восстановителями (в зависимости от второго участника реакции). Молекулы таких веществ содержат элементы в промежуточной степени окисления: N2, HNO2, S, SO2, H2SO3, FeSO4, FeCl2.
Частицы с промежуточными степенями окисления могут и отдавать, и присоединять электроны.
Все простые вещества-неметаллы (кроме F2) могут быть и окислителями, и восстановителями. Все простые вещества-металлы могут быть только восстановителями.
Рассмотрим взаимодействие металлов с кислотами. Кислоты в реакциях с металлами являются окислителями. В зависимости от природы кислоты, окислителем может быть ион Н+ или ион кислотного остатка:
1) окислителем в кислоте является ион водорода Н+. Это кислоты: соляная HCl (любого состава) и серная H2SO4 (разбавленная).
0 + 2+ 0
Zn + 2HCl = ZnCl2 + H2↑
восстановитель Zn, отдает электроны; окислитель Н+ получает электроны и получается газ водород.
Запомните!
С соляной кислотой НСl и разбавленной серной кислотой H2SO4 реагируют только те металлы, которые в ряду активности металлов находятся перед водородом. Остальные металлы не взаимодействуют с этими кислотами;
2) окислителем в кислоте является ион кислотного остатка. Это кислоты: серная H2SO4 (концентрированная) и азотная HNO3 (любого состава).
Запомните!
В концентрированной H2SO4 окислителем является ион кислотного остатка SO42-.
Металлы железо Fe, алюминий Al, золото Au, платина Pt не реагируют с концентрированной H2SO4 .
На холоде она пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах:
Fe + H2SO4 (конц.) ≠ (на холоде)
Остальные металлы восстанавливают ион SO42- до различных соединений: сернистого газа SO2, серы S, сероводорода H2S.
Обратите внимание:
Чем активнее металл, тем сильнее он восстанавливает ион SO42-. Например, самые активные металлы в ряду активности от лития Li до марганца Mn восстанавливают ион SO42- до Н2S. Металлы с меньшей активностью от марганца Mn до олова Sn могут восстанавливать ион SO42- до серы S. В случае малоактивных металлов от свинца Pb до серебра Ag ион SO42- восстанавливается до сернистого газа SO2. В результате реакции образуются также соль и вода.
Mg0 + H2SO4 (конц.) →MgSO4 + H2S↑ + H2O;
Zn0 + H2SO4 (конц.)→ZnSO4 + S↓ + H2O;
Cu0 + H2SO4 (конц.) →CuSO4 + SO2↑ + H2O.
Запомните!
В концентрированной HNO3 окислителем является ион кислотного остатка NO  , а не ионы H+, поэтому при взаимодействии HNO3 с металлами практически никогда не выделяется водород.
, а не ионы H+, поэтому при взаимодействии HNO3 с металлами практически никогда не выделяется водород.
+5 +2 +1
4Ca0+10HNO3 = 4Ca(NO3)2+N2O↑+5H2O.
Металлы железо Fe, алюминий Al, хром Cr, золото Au, платина Pt, не взаимодействуют с концентрированной HNO3. Остальные металлы ряда активности восстанавливают ион NO  до N2О (металлы от лития Li до марганца Mn) и до NО2 (от марганца Mn до серебра Ag).
до N2О (металлы от лития Li до марганца Mn) и до NО2 (от марганца Mn до серебра Ag).




| не реагируют Al, Cr, Fe, Au, Pt | от Li до Mn N2O | от Mn до Ag NO2 |
В результате реакции образуются также соль и вода.
Mg + HNO3 (конц.) → Mg(NO3)2 + N2O↑ + H2O;
Zn + HNO3 (конц.) → Zn(NO3)2 + NO2↑ + H2O;
Cu + HNO3 (конц.) → Cu(NO3)2 + NO2↑ + H2O.
Запомните!
В разбавленной HNO3 окислителем является также ион NO  . Металлы золото Au, платина Pt не реагируют с разбавленной HNO3.
. Металлы золото Au, платина Pt не реагируют с разбавленной HNO3.
Остальные металлы ряда активности восстанавливают ион NO  до иона NН
до иона NН  (металлы от лития Li до Mn, а также цинк Zn и железо Fe) и до NО (металлы от марганца Mn до серебра Ag).
(металлы от лития Li до Mn, а также цинк Zn и железо Fe) и до NО (металлы от марганца Mn до серебра Ag).




| не реагируют Au, Pt | от Li до Mn и Zn, Fe NH4NO3 | от Mn до Ag NO |
В результате реакции образуются также соль и вода.
Mg + HNO3 (разб.) → Mg(NO3)2 + NН4NO3↑ + H2O;
Zn + HNO3 (разб.) → Zn(NO3)2 + NН4NO3↑ + H2O;
Cu + HNO3 (разб.) → Cu(NO3)2 + NO + H2O.
Уравнения реакций взаимодействия металлов с кислотами составляются с помощью электронно-ионного баланса.
Пример 1. Исходя из степени окисления азота, серы и марганца в сoединениях NH3, НNO2, HNO3, H2S, Н2SO4, MnO2, KMnO4 определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисления в указанных соединениях соответственно равна n(N): -3 (низшая), +3 (промежуточная),+5 (высшая); n (S) соответственно равна: -2 (низшая), +4 (промежуточная), +6 (высшая); n (Мn) соответственно равна: +4 (промежуточная), +7 (высшая). Отсюда: NH3, H2S - только восстановители; HNO2, H2SO3, MnO2 – окислители и восстановители.
Пример 2. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: a) H2S и HJ; б) Н2S и H2SО3; b) H2SО3 и НСlO4?
Решение. а) степень окисления в Н2S n (S) = -2; в HJ n (1) = -1. Так как и сера, и йод находятся в своей низшей степени окисления, то оба взятые вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут; б) в H2S n (S) = -2 (низшая); в H2SO3 n (S) = +4 (промежуточная). Следовательно, взаимодействие этих веществ возможно, причем H2SO3 является окислителем; в) в H2SO3 n (S)= +4 (промежуточная); в НСlO4 n (С1) = +7 (высшая). Взятые вещества могут взаимодействовать. Н2SO3 в этом случае будет проявлять восстановительные свойства.
Различают три типа окислительно-восстановительных реакций:
- межмолекулярные – идут с изменением степеней окисления атомов в различных молекулах. Например:
+7 -1 +2
2KMnO4 + 10KJ + 8H2SO4 = 2MnSO4 + 5J  + 6K2SO4 + 8H2O;
+ 6K2SO4 + 8H2O;
- внутримолекулярные, в которых атомы, изменяющие свои степени окисления, находятся в одной молекуле. Например:
+5 -2 -1 0
2KClO3 = 2KCl + O2;
- диспропорционирования (самоокисления-самовосстановления), идут с изменением степени окисления атомов одного и того же элемента. Например:
0 -1 +5
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O.
Date: 2015-10-19; view: 669; Нарушение авторских прав