
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Факторы, влияющие на скорость химических реакций. 1. Влияние концентрации веществ
|
|
1. Влияние концентрации веществ.
Для протекания химической реакции необходимо соударение реагирующих частиц межу собой. Поэтому при увеличение концентрации веществ возрастает вероятность их столкновения, а следовательно, увеличивается скорость химической реакции.
Количественная зависимость скорости реакции от концентрации описывается законом действия масс: « Скорость прямой реакции прямопропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов в уравнении реакции”.
Так, для условной реакции aA + bB = cC + dD скорость прямой реакции  , а скорость обратной реакции
, а скорость обратной реакции  , где [A], [B], [C] и [D] – концентрации веществ; a, b, c и d – коэффициенты в уравнении реакции; k1 и k2 – константы скорости реакций.
, где [A], [B], [C] и [D] – концентрации веществ; a, b, c и d – коэффициенты в уравнении реакции; k1 и k2 – константы скорости реакций.
Константа скорости прямой реакции k1 численно равна скорости реакции при концентрациях реагирующих веществ, равных единице. Она не зависит от концентраций веществ, а зависит от их природы и температуры.
В случае протекания гетерогенных реакций в кинетическом уравнении будут учитываться концентрации только тех веществ, которые находятся в жидком или газообразном состоянии. Концентрация твердых веществ величина постоянная, и она входит в значение константы скорости.
Так, для реакции S (кр.) + Н2 (г) = Н2S (г) скорость прямой реакции определяется следующим уравнением: 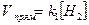 .
.
Пример. Как изменится скорость прямой реакций при увеличении концентрации оксида серы (IV) в 4 раза?
2SO2 + O2 = 2SO3,
 - до изменения концентрации SO2;
- до изменения концентрации SO2;
 - после изменения концентрации SO2;
- после изменения концентрации SO2;
Следовательно, скорость прямой реакции увеличивается в 16 раз.
2. Природа реагирующих веществ.
Химические реакции протекают, когда происходит, соударение реагирующих частиц. Однако не каждое соударение приводит к образованию нового химического соединения. Для того, чтобы произошло химическое превращение, необходимо, чтобы частицы реагирующих веществ обладали энергией, достаточной на разрыв старых связей и образования новых. Избыточная энергия, которой должны обладать молекулы, чтобы при их столкновении образовалось новое соединение, называется энергией активации. Каждой химической реакции соответствует своя энергия активации, ее значение определяется природой реагирующих веществ. Чем меньше ее величина, тем быстрее протекает химическое превращение, и наоборот.
3. Влияние температуры.
При увеличении температуры энергия молекул увеличивается, т.е. возрастает число молекул, энергия которых равна или превышает энергию активации реакции. Такие молекулы называются активными. Следовательно, с ростом температуры увеличивается скорость химической реакции.
Количественная связь температуры и скорости химической реакции описывается правилом Вант-Гоффа.
При изменении температуры на каждые десять градусов скорость химической реакции изменяется в 2-4 раза.
Это правило выражается следующим соотношением:  ,
,
где  - скорость реакции при начальной температуре t1,
- скорость реакции при начальной температуре t1,
 - скорость реакции при конечной температуре t2,
- скорость реакции при конечной температуре t2,
γ – температурный коэффициент реакции.
4. Влияние катализатора.
Катализатор – это вещество, которое влияет на скорость химической реакции, но само при этом не расходуется. Катализаторы, ускоряющие химические процессы, называются положительными. В присутствии катализатора реакции протекают по новому пути с меньшей энергией активации, что и приводит к увеличению скорости химической реакции.
Процесс с участием катализатора называются катализом. Катализ может быть гомогенным и гетерогенным.
Date: 2015-10-19; view: 463; Нарушение авторских прав