
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Определение и характеристики химической связи
|
|
Под термином химическая связь понимают разные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений. Химическая связь осуществляется путем перераспределения электронов между
подобно атомным орбиталям,
определенной энергией и формой. Молекулярная орбиталь охватывает не один атомами. В результате этого процесса каждый атом приобретает конфигурацию внешней электронной оболочки, аналогичную устойчивой электронной оболочке инертного газа (октетная электронная конфигурация). Основной чертой химической связи является снижение общей энергии двух- или многоатомной системы по сравнению с суммарной энергией изолированных частиц, из которых эта система образована.
Химическая связь характеризуется рядом параметров.
Энергией связи (Ехс) называют энергию, которую необходимо затратить на её разрыв. Эта величина определяет прочность химической связи, единица её измерения кДж/моль. В большинстве соединений величина энергии химической связи колеблется в диапазоне
100 – 1000 кДж/моль. Зная Ехс в молекуле можно судить о ее реакционной способности.
Длиной связи (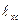 ) называют расстояние между ядрами взаимодействующих атомов. Эта величина зависит от размеров электронных оболочек атомов и степени их перекрывания. Имеется определенная корреляция между вышеобозначенными характеристиками – с уменьшением длины химической связи обычно растет энергия связи и соответственно устойчивость молекул (табл.).
) называют расстояние между ядрами взаимодействующих атомов. Эта величина зависит от размеров электронных оболочек атомов и степени их перекрывания. Имеется определенная корреляция между вышеобозначенными характеристиками – с уменьшением длины химической связи обычно растет энергия связи и соответственно устойчивость молекул (табл.).
Валентный угол - угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов. Величины валентных углов зависят от природы атомов и характера связи. Простые двухатомные молекулы имеют линейную структуру, более сложные молекулы обладают различными конфигурациями. Например, молекула воды имеет угловое строение (104,5 ◦).
Date: 2015-10-19; view: 450; Нарушение авторских прав