
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

В водных растворах
|
|
| Окислительно-восстановительная пара (ОВП) | Уравнение реакции восстановления | Ео298, В |
| Соединения азота | ||
| (Н+) NO-3/NO2 (Н2О) | NO−3 + 2H+ +  «NO2+ H2O «NO2+ H2O
| +0,78 |
| (Н+) NO-3/HNO2 (Н2О) | NO−3 + 3H+ + 2  «HNO2+ H2O «HNO2+ H2O
| +0,93 |
| (Н+) NO-3/NO-2 (Н2О) | NO−3 + 2H+ + 2  «NO2− + H2O «NO2− + H2O
| +0,94 |
| (Н+) NO-3/NO (Н2О) | NO−3 + 4H+ + 3  «NO+ 2H2O «NO+ 2H2O
| +0,96 |
| (Н+) NO-2 /N2 (ОН-) | NO−2 + 2H+ + 2  «N2 + 2OH− «N2 + 2OH−
| +0,99 |
| (Н+) 2NO2/N2 (Н2О) | 2NO2 + 8H+ + 8  «N2 + 4H2O «N2 + 4H2O
| +1,36 |
| (Н+) 2HNO2/N2 (Н2О) | 2HNO2 + 6H+ + 6  «N2 + 4H2O «N2 + 4H2O
| +1,45 |
| (Н+) 2NO/N2 (Н2О) | 2NO + 4H+ + 4  «N2 + 2H2O «N2 + 2H2O
| +1,68 |
| Соединения бора | ||
| (Н+) H3BO3/B (Н2О) | H3BO3 + 3H+ + 3  «B + 3H2O «B + 3H2O
| −0,71 |
| Соединения брома | ||
| BrO-3/Br- (OH-) | BrO−3 + 3H2O + 6  «Br− + 6OH− «Br− + 6OH−
| +0,60 |
| Br2/2Br- | Br2 + 2  «2Br− «2Br−
| +1,09 |
| (Н+) BrO-3/Br- (Н2О) | BrO−3 + 6H+ + 6  «Br− + 3H2O «Br− + 3H2O
| +1,44 |
| (Н+) 2BrO-3/Br2 (Н2О) | 2BrO−3 + 12H+ + 10  «Br2 + 6H2O «Br2 + 6H2O
| +1,52 |
| Соединения йода | ||
| (Н2О) JO-3/J- (OH-) | JO−3 + 6H2O + 6  «J− + 6OH− «J− + 6OH−
| +0,26 |
| J2/2J- | J2 + 2  «2J− «2J−
| +0,53 |
| (H+) JO-3/J- (Н2О) | JO−3 + 6H+ + 6  «J− + 3H2O «J− + 3H2O
| +1,09 |
| (H+) 2JO-3/J2 (Н2О) | 2JO−3 + 12H+ + 10  «J2 + 6H2O «J2 + 6H2O
| +1,20 |
| Соединения кислорода | ||
| (Н2О) H2O/H2 (OH-) | 2H2O + 2  «H2 «H2 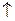 + 2OH− + 2OH−
| −0,83 |
| (Н2О) O2/H2O2 (OH-) | O2 + 2H2O + 2  «H2O2 + 2OH− «H2O2 + 2OH−
| −0,08 |
| (H+) O2/H2O2 | O2 + 2H+ + 2  «H2O2 «H2O2
| +0,68 |
| (H+) O2/2H2O (Н2О) | O2 + 4H+ + 4  «2H2O «2H2O
| +1,23 |
| (H+) H2O2/2H2O (Н2О) | H2O2 + 2H+ + 2  «2H2O «2H2O
| +1,78 |
| Соединения марганца | ||
| Mn2+/Mn | Mn2+ + 2  «Mn «Mn
| −1,18 |
| MnO4-/ MnO42- | MnO4- +  «MnO42− «MnO42−
| +0,56 |
| MnO4-/ MnO2(OH-) | MnO4− + 2H2O + 3  «MnO2 + 4OH− «MnO2 + 4OH−
| +0,57 |
| MnO42- / MnO2(OH-) | MnO42- + 2H2O + 2 «MnO2 + 4OH- «MnO2 + 4OH-
| +0,58 |
| Продолжение табл. 11 | |||
| Окислительно-восстановительная пара (ОВП) | Уравнение реакции восстановления | Ео298, В | |
| (H+) MnO2/Mn2+ | MnO2 + 4H+ + 2  «Mn2+ + 2H2O «Mn2+ + 2H2O
| +1,24 | |
| (H+)MnO4-/ Mn2+ (Н2О) | MnO4− + 8H+ + 5  «Mn2+ + 4H2O «Mn2+ + 4H2O
| +1,53 | |
| (H+)MnO4-/ МnO2(Н2О) | MnO4− + 4H+ + 3  «MnO2 + 2H2O «MnO2 + 2H2O
| +1,73 | |
| Соединения свинца | |||
| Pb2+/Pb | Pb2+ + 2  «Pb «Pb
| −0,13 | |
| (H+) PbO2/ Pb2+ (Н2О) | PbO2+ 4H+ +SO42− +2  «PbSO4+ H2O «PbSO4+ H2O
| +1,46 | |
| Pb4+/ Pb2+ | Pb4++ 2  «Pb2+ «Pb2+
| +1,69 | |
| Соединения серы | |||
| (Н2О)SO42-/ SO32-(OH-) | SO42−+ H2O + 2  «SO32−+ 2OH− «SO32−+ 2OH−
| −0,93 | |
| (H+) SO42-/ S2- (Н2О) | SO42− + 8H+ + 8  «S2−+ 4H2O «S2−+ 4H2O
| −0,15 | |
| (H+) S/H2S | S + 2H+ + 2  «H2S «H2S
| +0,17 | |
| (H+)SO42-/ SO32- (Н2О) | SO42− + 2H+ + 2  «SO32− + H2O «SO32− + H2O
| +0,20 | |
| Соединения фосфора | |||
| (H+) PO43- /P (Н2О) | PO43- + 8H+ + 5  «P + 4H2O «P + 4H2O
| −0,38 | |
| (H+) PO43- /PO33- (Н2О) | PO43− + 2H+ + 2  «PO33− + H2O «PO33− + H2O
| −0,28 | |
| (H+) P/PH3 | Р + 3Н+ + 3  «РН3 «РН3
| −0,04 | |
| Соединения хлора | |||
| Cl2/2Cl- | Cl2 + 2  «2Cl− «2Cl−
| +1,36 | |
| (H+) ClO3-/Cl- (Н2О) | ClO3− + 6H+ + 6  «Cl− + 3H2O «Cl− + 3H2O
| +1,45 | |
| (H+) 2ClO3-/Cl2 (Н2О) | 2ClO3− + 12H+ + 10  «Cl2 + 6H2O «Cl2 + 6H2O
| +1,47 | |
| (H+) 2ClO-/Cl2 (Н2О) | 2ClO− + 4H+ + 2  «Cl2 + 2H2O «Cl2 + 2H2O
| +1,63 | |
| Соединения хрома | |||
| Cr3+/Cr | Cr3+ + 3  «Cr «Cr
| −0,74 | |
| (Н2О)CrO42- /Cr(OH)3 | CrO42− + 4H2O + 3 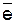 «Cr(OH)3 + 5OH− «Cr(OH)3 + 5OH−
| −0,13 | |
| (H+) CrO42-/Cr (Н2О) | CrO42- + 8H+ + 6 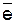 «Cr + 4H2O «Cr + 4H2O
| +0,37 | |
| (H+)CrO42-/CrO2-(Н2О) | CrO42− + 4H+ + 3  «CrO2− + 2H2O «CrO2− + 2H2O
| +0,95 | |
| (H+)Cr2O72-/2Cr3+(Н2О) | Cr2O72− + 14H+ + 6  «2Cr 3++ 7H2O «2Cr 3++ 7H2O
| +1,33 | |
| (H+) CrO42-/Cr3+ (Н2О) | CrO42−+ 8H+ + 3  «Cr3++ 4H2O «Cr3++ 4H2O
| +1,48 | |
| Другие соединения | |||
| (H+) As/AsH3 | As + 3H+ + 3  «AsH3 «AsH3
| −0,54 | |
| Sn2+/Sn | Sn2+ + 2  «Sn «Sn
| −0,14 | |
| Fe3+/Fe2+ | Fe3+ +  «Fe2+ «Fe2+
| +0,77 | |
| F2/2F- | F2 + 2  «2F− «2F−
| +2,85 | |
Таблица 12
Стандартные потенциалы металлических электродов
(ряд напряжений)
| Электрод | Электродный процесс | Ео, В 
|
| Li+/ Li | Li+ + ē  Li Li
| −3,040 |
| Rb+/ Rb | Rb+ + ē  Rb Rb
| −2,925 |
| К+/ К | К++ ē  К К
| −2,925 |
| Cs+/ Cs | Cs+ + ē  Cs Cs
| −2,923 |
| Ba2+/ Ba | Ba2+ + 2ē  Ba Ba
| −2,906 |
| Ca2+/ Ca | Ca2+ + 2ē  Ca Ca
| −2,866 |
| Na+/ Na | Na+ + ē  Na Na
| −2,714 |
| Mg2+/ Mg | Mg2+ + 2ē  Mg Mg
| −2,363 |
| Be2+/ Be | Be2++ 2ē  Ве Ве
| −1,847 |
| Al3+/ Al | Al3+ + 3ē  Al Al
| −1,662 |
| Ti2+/ Ti | Ti2+ + 2ē  Ti Ti
| −1,628 |
| Mn2+/ Mn | Mn2+ + 2ē  Mn Mn
| −1,180 |
| Zn2+/ Zn | Zn2+ + 2ē  Zn Zn
| −0,763 |
| Cr3+/ Cr | Cr3+ + 3ē  Cr Cr
| −0,744 |
| Fe2+/ Fe | Fe2+ + 2ē  Fe Fe
| −0,440 |
| Cd2+/ Cd | Cd2+ + 2ē  Cd Cd
| −0,403 |
| Co2+/ Co | Co2+ + 2ē  Co Co
| −0,277 |
| Ni2+/ Ni | Ni2+ + 2ē  Ni Ni
| −0,250 |
| Mo3+/Mo | Mo3+ + 3ē  Mo Mo
| −0,200 |
| Sn2+/ Sn | Sn2+ + 2ē  Sn Sn
| −0,136 |
| Pb2+/ Pb | Pb2+ + 2ē  Pb Pb
| −0,126 |
| Fe3+/ Fe | Fe3+ + 3ē  Fe Fe
| −0,036 |
| 2H+/ H2 | 2H+ + 2ē  H2 H2
| +0,000 |
| Sb2+/ Sb | Sb2+ + 2ē  Sb Sb
| +0,200 |
| Bi3+/ Bi | Bi3+ + 3ē  Bi Bi
| +0,220 |
| Cu2+/ Cu | Cu2+ + 2ē  Cu Cu
| +0,337 |
| Hg22+/ 2Hg | Hg22++ 2ē  2Hg 2Hg
| +0,790 |
| Ag+/ Ag | Ag+ +ē  Ag Ag
| +0,799 |
| Hg2+/ Hg | Hg2+ +2ē  Hg Hg
| +0,854 |
| Pd2+/ Pd | Pd2+ + 2ē  Pd Pd
| +0,987 |
| Pt2+/ Pt | Pt2+ + 2ē  Pt Pt
| +1,190 |
| Au3+/ Au | Au3+ + 3ē  Au Au
| +1,498 |
ВОПРОСЫ
для подготовки к зачету по курсу «Химия»
Date: 2015-10-19; view: 628; Нарушение авторских прав