
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электродные потенциалы
|
|
В металле существует динамическое равновесие:
Ме «Меn++ 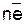 ,
,
где Ме – атом металла, Меn+ – ион металла, n – заряд иона металла,  –электрон. Ионы и атомы металла находятся в узлах кристаллической решетки, а валентные электроны (или их часть) перемещаются по всему объему металла.
–электрон. Ионы и атомы металла находятся в узлах кристаллической решетки, а валентные электроны (или их часть) перемещаются по всему объему металла.
При погружении металла в воду или раствор электролита начинается взаимодействие ионов поверхностного слоя металла, находящихся в узлах решетки, с компонентами раствора, главным образом с полярными молекулами воды, ориентированными у поверхности электрода. В результате часть ионов поверхностного слоя металла переходит в раствор в виде гидратированных ионов (Меn+  mH2O), а на металле остаются электроны, заряд которых не скомпенсирован положительно заряженными ионами.
mH2O), а на металле остаются электроны, заряд которых не скомпенсирован положительно заряженными ионами.
Металл становится заряженным отрицательно, а раствор положительно. В результате электростатического притяжения между катионами Меn+в растворе и избыточными электронами в поверхностном слое металла образуется двойной электрический слой (рис. 8.1).
Накопление ионов металла в растворе начинает тормозить дальнейшее растворение металла. Протекает обратная реакция – восстановление ионов металла с осаждением их на поверхности металла.
Ионы металла (Меn+) находятся под действием силы притяжения их молекулами воды и силы, стремящейся «втянуть» ионы обратно в металл, т.е. одновременно протекают два противоположных процесса: растворение и кристаллизация, что приводит к равновесию
Me + mH2O  Меn+∙mH2O(в растворе) +
Меn+∙mH2O(в растворе) + 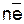 (на металле).
(на металле).

Рис. 8.1. Схема процесса, протекающего на границе раздела
«металл (Сu)/ вода»
Равновесие имеет динамический характер, так как прямой и обратный процессы идут с одинаковой скоростью в прямом и обратном направлениях. Состояние равновесия электродного процесса определяется электродным потенциалом.
На границе соприкосновения металла с жидкой фазой возникает разность потенциалов (скачок потенциала).
Разность потенциалов, возникающая между металлом и окружающей его водной средой, называется электродным потенциалом.
Абсолютное значение разности потенциалов на границе металл/ электролит принципиально измерить нельзя никакими средствами, так как на возникает между двумя фазами разной природы (твердой металл/жидкий раствор). Однако можно измерить разность потенциалов двух различных электродов, приняв один из них за электрод сравнения.
В качестве электрода сравнения, согласно международному соглашению, используют стандартный водородный электрод.
 8.3. Стандартный водородный электрод
8.3. Стандартный водородный электрод
Конструктивно с тандартный водородный электрод состоит из платиновой пластинки, покрытой слоем электролитической платины− платиновой чернью, контактирующей с газообразным водородом под давлением 1 атм и раствором серной кислоты с активностью ионов водорода 1 моль/л.
В водородном электроде происходит реакция, аналогичная реакциям, протекающим на поверхности металлических электродов. Pt выполняет роль инертного проводника, а ее поверхностный слой адсорбирует (концентрирует) водород. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя на платине электроны. При этом платина заряжается отрицательно, а раствор – положительно. Возникает скачок потенциала между платиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода.
Равновесие на водородном электроде можно представить в виде
2Н+ + 2 
 Н2.
Н2.
Схематически водородный электрод обозначают 2Н+/Н2, где вертикальная черта – поверхность раздела фаз.
Электродный потенциал стандартного водородного электрода условно принят за нуль (Е о2Н+ / Н2 = 0,00 В).
Стандартным электродным потенциалом (Ео298) называется электродный потенциал, определенный относительно стандартного водородного электрода в стандартных условиях, т.е. при концентрации (активности) ионов металла в растворе 1 моль/л и температуре 25оС (298 К).
Для определениястандартных электродных потенциалов металлов (Е о298) составляется гальванический элемент из двух элементов: стандартного водородного электрода и электрода, представляющего собой металлическую пластину, погруженную в раствор соли этого металла с концентрацией(активностью) ионов металла 1 моль/л, и измеряют электродвижущую силу элемента (рис. 8.2).
Измерение осуществляют методом компенсации в условиях обратимой работы его работы (при отсутствии тока в цепи).
ЭДС элемента равна разности равновесных потенциалов положительного электрода (катода) и отрицательного электрода (анода). Так как потенциал водородного электрода принимается равным нулю, то относительный потенциал определяемого электрода будет равен ЭДС элемента.
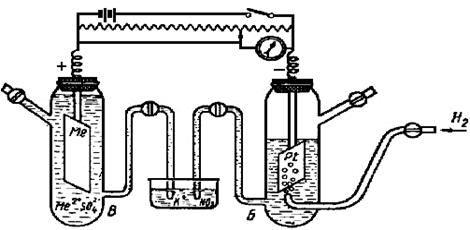
Рис. 8.2. Ячейка для измерения электродного потенциала металла:
А - аккумулятор; Б – стандартный водородный
электрод; В – металлический электрод
Знак электродного потенциала характеризует активность металла относительно водорода. Металлы имеют электродные потенциалы со знаком «минус», если их активность выше активности водорода и «плюс», если они менее активны, чем водород.
Стандартные электродные потенциалы металлов являются характеристикой активности металлов. Стандартные электродные потенциалы металлов, расположенные в ряд по мере возрастания значений стандартных электродных потенциалов, представляют собой ряд стандартных электродных потенциалов (ряд напряжений металлов) (Прил., табл. 12).
Date: 2015-10-19; view: 641; Нарушение авторских прав