
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения типовых задач. Пример 1. Укажите, какие из приведенных соединений HNO3, NO, NH3 могут проявлять только окислительные
|
|
Пример 1. Укажите, какие из приведенных соединений HNO3, NO, NH3 могут проявлять только окислительные, только восстановительные и как окислительные, так и восстановительные свойства.
Решение. HNO3 – всегда окислитель, так как содержит азот (N+5) в высшей степени окисления:
N+5 + 8 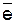 «N-3 (окислитель, процесс восстановления),
«N-3 (окислитель, процесс восстановления),
N+5 – 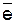 -/® (восстановительная способность отсутствует).
-/® (восстановительная способность отсутствует).
NO – может быть и окислителем, и восстановителем, так как содержит азот в промежуточной степени окисления (N+2):
N+2 «N+5 + 3 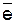 (процесс окисления, восстановитель),
(процесс окисления, восстановитель),
N+2 + 5 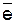 «N-3 (процесс восстановления, окислитель).
«N-3 (процесс восстановления, окислитель).
NH3 – всегда восстановитель, так как содержит азот в низшей степени окисления (N-3):
N-3 «N+5 + 8 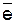 (процесс окисления, восстановитель)
(процесс окисления, восстановитель)
N-3 + 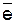 -/® (окислительная способность отсутствует).
-/® (окислительная способность отсутствует).
Пример 2. Объясните, возможны ли окислительно-восстанови-тельные реакции между следующими веществами: а) H2S и HJ; б) H2S и H2SO3; в) H2SO3 и HСlO4?
Решение.
а) Степень окисления серы в H2S равна – 2, степень окисления йода в HJ – (–1). Так как и сера, и йод находятся в низших степенях окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут.
б) В H2S сера имеет низшую степень окисления S-2; в H2SO3 сера находится в промежуточной степени окисления S+4.
Следовательно, взаимодействие этих веществ возможно, причем H2SO3 является окислителем.
в) степень окисления серы в H2SO3 равна +4, хлор в HСlO4 имеет высшую степень окисления +7. Реакция между H2SO3 и HСlO4 возможна, H2SO3 в этом случае проявляет восстановительные свойства.
Пример 3. Составьте уравнение окислительно-восстановитель-ной реакции, протекающей по схеме:
KMnO4 + H3PO3 + H2SO4(среда)  MnSO4 + H3PO4 + K2SO4 +H2O.
MnSO4 + H3PO4 + K2SO4 +H2O.
Решение. Определяем степени окисления элементов в исходных веществах и продуктах реакции:
 Осуществляем выбор окислителя и восстановителя.
Осуществляем выбор окислителя и восстановителя.
Окислитель − KMnO4 (степень окисления марганца в реакции понижается).
Восстановитель − H3PO3 (степень окисления фосфора в ходе реакции повышается).
Составляем уравнения электронного баланса для окислителя и восстановителя:
 восстановитель 5 Р+3
восстановитель 5 Р+3  Р+5 + 2
Р+5 + 2 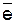 (процесс окисления),
(процесс окисления),
окислитель 2 Мn+7 + 5 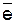
 Мn+2 (процесс восстановления).
Мn+2 (процесс восстановления).
 |
5Р+3 + 2Мn+7  5Р+5 + 2Мn+2.
5Р+5 + 2Мn+2.
Стехиометрические коэффициенты определяем методом электронного баланса с помощью электронных уравнений. Общее число электронов, отданных восстановителем, равно числу электронов, присоединяемых окислителем. Наименьшее общее кратное для отданных (2) и принятых (5) электронов равно 10. Для восстановителя и продукта его окисления получаем коэффициент 5, для окислителя и продукта его восстановления – коэффициент 2. Коэффициенты перед веществами, атомы которых не меняют свою степень окисления, находим методом подбора. Уравнение реакции будет иметь вид:
2КМnO4 + 5Н3РО3 + ЗН2SO4  2МnSO4 + 5Н3РО4 + К2SO4 + ЗН2O.
2МnSO4 + 5Н3РО4 + К2SO4 + ЗН2O.
Правильность подобранных коэффициентов определяем балансом кислорода в обеих частях уравнения (8+15+12=8+20+4+3).
Date: 2015-10-19; view: 607; Нарушение авторских прав