
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Модель излучающего электрона
|
|
Было замечено, что в спектрах атомов щелочных металлов, принадлежащих первой группе системы элементов (3Li, 11Na, 19K, 31Rb) имеются серии, по внешнему виду напоминающие серии водородоподобных атомов. Сходство состоит в том, что спектральные серии атомов щелочных металлов состоят из групп линий, расстояние между которыми уменьшается с ростом частоты, вплоть до границы серии (см. рис. 1).
| t к. |
 Так же, как и для спектров водородоподоб-ных атомов, волновое число любой линии серии можно представить в виде комбинации двух термов:
Так же, как и для спектров водородоподоб-ных атомов, волновое число любой линии серии можно представить в виде комбинации двух термов:
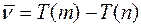 (1)
(1)
Однако имеется и отличие от водородоподобных атомов, состоящее в том, что выражение для термов щелочных металлов несколько видоизменено. Так, терм водородоподобного атома имеет вид:
 (2)
(2)
где п - главное квантовое число, принимающее значения 1,2,3,..∞.
Термы атомов щелочных металлов в знаменателе содержат некоторую поправку Δl:
 (3)
(3)
Выражение для энергии водородоподобного атома в этом энергетическом состоянии имеет вид:
 (4)
(4)
Аналогичное выражение для атома щелочного металла представимо в виде:
 (5)
(5)
При попытке применения формулы (1) для вычисления волновых чисел линий спектральных серий атомов щелочных металлов выяснилось, что внутри каждой наблюдаемой серии термов поправка Δ l имеет своезначение.
Описанные особенности спектров атомов щелочных металлов удалось объяснить с помощью модели излучающего электрона. Сущность этой модели состоит в следующем.
В периодической системе элементов щелочные металлы следуют за инертными газами: 3 Li после 2He, 11Na после 10Ne и т.д. Поэтому, рассматривая атом некоторого щелочного металла, содержащего Z электронов, можно утверждать, что (Z-1) электронов этого атома образуют устойчивую структуру предыдущего инертного газа, а последний электрон связан с ядром относительно слабо. В этом случае Z-1 внутренних электронов с общим отрицательным зарядом -(Z -1) е вместе с ядром с положительным зарядом Ze образуют устойчивый "остов", напоминающий ядро с зарядом + е. В поле этого "эффективного ядра" движется последний слабо связанный электрон, обычно называемый излучающим или валентным. Для атома лития схематически это можно представить с помощью рис. 2.
Таким образом, получается система, напоминающая водородоподобный атом, заряд которого равен +е, содержащий один электрон, чем и объясняется сходство спектральных серий щелочных металлов и ионов.
 Отличия в энергети-ческих состояниях такой системы от энергетичес-ких состояний водород-ных атомов могут быть объяснены учетом следу-ющих факторов:
Отличия в энергети-ческих состояниях такой системы от энергетичес-ких состояний водород-ных атомов могут быть объяснены учетом следу-ющих факторов:
1. Ядра водородопо-добных ионов представ-ляют собой систему чрез-вычайно жестко связан-ных частиц. Остов, или эффективное ядро атомов щелочных металлов не является неизменяемой системой. Так, поле самого валентного электрона, близко подошедшего к эффективному ядру, вызывает его поляризацию, что приводит к нарушению сферической симметрии поля, создаваемого деформированным остовом.
2. Второй причиной этого отличия является проникновение валентного электрона внутрь атомного остатка (т.е. имеется отличная от нуля вероятность обнаружения электрона внутри атомного остатка), что исключено в случае водородоподобных ионов.
Решение квантовомеханической задачи о щелочных атомах показывает, что поправка Δl, стоящая в знаменателе выражения для терма атома щелочного металла, оказывается обратно пропорциональной l +1/2, где l - орбитальное квантовое число, квантующее собственные
значения орбитального момента импульса  , и принимающее значения 0, 1, 2,...(п -1). Состояния с различными значениям l обозначается разными символами в соответствии с приведённой ниже таблицей
, и принимающее значения 0, 1, 2,...(п -1). Состояния с различными значениям l обозначается разными символами в соответствии с приведённой ниже таблицей
| Значения l | ||||||
| Символ состояния | S | P | D | F | G | H |
Известно, что в атоме водорода имеет место вырождение по орбитальному квантовому числу. Это явление состоит в том, что энергия водородного атома определяется лишь главным квантовым числом п и не зависит от l. Поэтому термы S, P, D, F,... при данном n слиты в один терм.
Поскольку упомянутая выше поправка Δl, вводимая для описания системы термов атомов щелочных металлов, зависит от l, термы S, P, D, F,... при одном и том же п уже не будут одинаковыми по величине, вырождение снимается и энергетические уровни расщепляются, как это схематически показано на рис. 3.

Из приведённой схемы видно, что энергия будет определяться теперь не только п,но и l. При этом расщепление может оказаться настолько большим, что уровни будут перекрываться, т.е. может оказаться, что некоторый уровень с бóльшимзначением главного квантового числа будетрасположен по энергии ниже некоторого уровня с меньшим значением п. На рис.4 приведена схема энергетических уровней атома натрия. На практике оказалось, что оптические переходы возможны не для любых комбинаций термов, а лишь для таких, для которых изменение орбитального квантового числа происходит на единицу:  .
.
Это условие получило название правила отбора.
В спектрах атомов щелочных металлов различают следующие четыре серии:

 |
1. Главная серия возникает при переходах в нижнее (основное) состояние S со всех вышележащих Р - состояний.
2. Диффузная серия возникает при переходах в нижнее Р - состояние со всех вышележащих D - состояний.
 3. Резкая серия соответствует переходам в нижнее Р – состояние со всех вышележащих S - состояний.
3. Резкая серия соответствует переходам в нижнее Р – состояние со всех вышележащих S - состояний.
4. Фундаментальная серия возникает при переходах в нижнее D - состояние со всех вышележащих F -состояний.
На рис. 4 представлены переходы, соответствующие нескольким линиям из этих серий для натрия; наименьшее значение главного квантового числа для излучающего электрона этого атома равно 3, т.к. все квантовые состояния с меньшими значениями п заняты электронами, входящими в состав атомного остатка.
При детальном рассмотрении спектрограмм оказывается, что спектральные линии, соответствующиепереходам, изображенным стрелками на рис. 4, представляют собой дублеты или триплеты, т.е. две или три близкорасположенные линии. Это явление естественно связать с расщеплением энергетических состояний атомов щелочных металлов, происходящим в результате взаимодействия орбитального момента электрона с его собственным (спиновым) моментом (т.н. спин-орбитальное взаимодействие). При анализе спин-орбитального взаимодействия вводится понятие полного момента атома, представляющего сумму орбитального и спинового моментов
 .
.
Согласно квантово-механическому правилу сложения моментов импульсов, квантовое число j, квантующее полный момент импульса атома, принимает следующие значения: j=l+s, l+s-1, l+s-2, …, | l-s |, где l и s - орбитальное и спиновое квантовые числа, соответственно. Поскольку в атомах щелочных металлов всего один валентный электрон, s =±1/2 и j=l± 1/2, т.е. принимает всего два значения. Каждому из этих значений соответствует определённая ориентация спинового момента импульса  относительно орбитального момента импульса
относительно орбитального момента импульса  . Поскольку с механическим моментом импульса связан соответствующий ему магнитный момент, возникает взаимодействие: между магнитным полем, создаваемым орбитальным движением электрона и его собственным магнитным моментом μs. Энергия этого взаимодействия может быть представлена в виде скалярного произведения:
. Поскольку с механическим моментом импульса связан соответствующий ему магнитный момент, возникает взаимодействие: между магнитным полем, создаваемым орбитальным движением электрона и его собственным магнитным моментом μs. Энергия этого взаимодействия может быть представлена в виде скалярного произведения:
 ,
,
|
|
|
 относительно
относительно  , дополнительная энергия, обусловленная спин-орбитальным взаимодействием, принимает два значения, и каждый энергетический уровень расщепляется на два подуровня. Нерасщеплённым оказываются лишь S -состояния, для которых l = 0, и, следовательно, равно нулю магнитное поле, создаваемое орбитальным движением электрона.
, дополнительная энергия, обусловленная спин-орбитальным взаимодействием, принимает два значения, и каждый энергетический уровень расщепляется на два подуровня. Нерасщеплённым оказываются лишь S -состояния, для которых l = 0, и, следовательно, равно нулю магнитное поле, создаваемое орбитальным движением электрона. 
Для учёта описанного расщепления уровней в символ, описывающий состояние атома, вводится дополнительный индекс j, записываемый справа внизу от символа состояния: n· Xj. При этом оказывается, что переходы осуществляются между различными подуровнями, если выполнены правила отбора по квантовому числу j: Δj = 0, ±1.
Дублеты главной серии натрия возникает по схеме, приведённой на рис. 5а. Схема рисунка 5б иллюстрирует появление дублетов резкой серии. Диффузная серия состоит из триплетов (рис. 5в), поскольку переходы, обозначенные пунктирными стрелками, запрещены правилами отбора по внутреннему квантовому числу. По этой же причине состоит из триплетов фундаментальная серия, возникающая при переходах nF→3D.
Таким образом, проведённое выше рассмотрение, основанное на модели излучающего электрона, позволяет понять все особенности структуры спектров атомов щелочных металлов.
Date: 2015-10-19; view: 1150; Нарушение авторских прав