
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 5 Новинки рефракционной хирургии
|
|
Ежегодно в офтальмологии появляются многочисленные новые методы диагностики и лечения. Через несколько лет все изложенное в этой главе может стать общим местом, неотъемлемой составляющей работы большинства офтальмологических клиник. А некоторые нововведения будут признаны ненужными в клинической практике и будут использоваться только в научно-исследовательской деятельности.
Диагностическая аппаратура
Кератотопограф с функцией трехмерного снимка переднего отрезка глазного яблока (Pentacam). Позволяет не только исследовать рефракцию передней и задней поверхности роговицы, но и проводить бесконтактную пахиметрию (определение толщины роговицы), определять оптическую плотность хрусталика, измерять угол передней камеры и вообще дает трехмерный снимок передней камеры. Каких-либо новых характеристик для рефракционной хирургии аппарат не дает. Та же кератотопография, что и обычно. Пожалуй, более показательна диагностика кератоконуса. Не только локальное усиление преломления, но и место выпячивания роговицы в сагиттальной плоскости, то есть в профиль, и пахиметрия на вершине кератоконуса. Заодно и более подробная диагностика радужки и хрусталика во время предоперационного обследования.
Оптические сканеры. Их великое множество. Вот лишь некоторые:
лазерный сканирующий конфокальный офтальмоскоп (ретинотомограф HRT);
оптический когерентный томограф (Stratus OCT);
сканирующий лазерный поляриметр (GDx VCC);
анализатор толщины сетчатки (RTA).
Основное их предназначение – цифровой анализ состояния сетчатки. После лазерной коррекции уменьшается толщина роговицы, что затрудняет определение истинного внутриглазного давления. В такой ситуации можно не заметить развития глаукомы. Сканеры могут диагностировать глаукому вне зависимости от измерения давления (то есть глаукому и с низким давлением). Они выявляют мельчайшие изменения диска зрительного нерва, прогибающегося под действием повышенного внутриглазного давления при глаукоме, либо соответствующие изменения толщины сетчатки.
Причем у двух первых сканеров есть модификации, позволяющие обследовать роговицу. У лазерного сканирующего офтальмоскопа HRT есть роговичный модуль, позволяющий проводить конфокальную микроскопию роговицы. А у оптического когерентного томографа есть модели, позволяющие делать снимки роговицы в сагиттальной плоскости. Это позволяет проводить измерение не только толщины роговицы, но и, например, толщину роговичного лоскута или оценивать глубину бельма и др. Такой прибор можно применять не только для предоперационного обследования, но и для послеоперационного динамического наблюдения за состоянием роговицы после корнеорефракционной операции (включая ЛАСИК).
Конфокальный микроскоп. Такой микроскоп может быть как отдельным аппаратом (Confoscan), так и модулем лазерного сканера (модуль Rostock ретинотомографа HRT). Его функция – прижизненная гистология роговицы и других тканей переднего отрезка глазного яблока. Аппарат практически не прикасается к глазу, но на мониторе компьютера становится видна роговица на клеточном уровне. Можно определить плотность клеток эпителия, стромы или эндотелия роговицы (HRT) или измерить толщину того же роговичного лоскута. И многое другое.
HRT неплохо зарекомендовал себя в послеоперационном динамическом наблюдении ЛАСИК, дифдиагностике наследственных дистрофий роговицы, определении показаний к фототерапевтическому лечению бельм. А уж по части диагностики глаукомы с низким давлением его вообще именуют «золотым стандартом». Однако на самом деле спектр его клинического применения еще до конца не определен и находится в стадии развития (см. книгу «Лазерная томография глаза: передний и задний отрезок». Азнабаев Б.М. и др.).
Анализатор биомеханических свойств роговицы. Если у рефракционной клиники нет оптического сканера для диагностики глаукомы, то клиника обязана иметь анализатор биомеханических свойств роговицы.
Пройдет несколько лет и люди, которым была проведена лазерная коррекция зрения, в большинстве своем достигнут сорокалетнего возраста. После сорока лет у всех людей появляется риск развития катаракты и глаукомы. Чтобы вовремя выявить глаукому, всем в этом возрасте необходимо хотя бы один раз в год измерять внутриглазное давление. Те, кто делал лазерную коррекцию, должны измерять давление в рефракционных клиниках. Единственный аппарат, который покажет истинное давление у людей с тонкой роговицей (и со слишком толстой, кстати говоря, тоже), – анализатор биомеханических свойств роговицы.
Новое в лазерной коррекции
Эксимерлазерные установки постоянно совершенствуются, но каких-либо революционных нововведений почти нет. Конечно, если считать не новым, а вполне стандартным персонализированную лазерную коррекцию, автоматическую систему слежения за глазом, точечную подачу лазерного луча и систему вентиляции операционного поля (эвакуация продуктов абляции сооружением, подобным микропылесосу). Принципиальными нововведениями на сегодняшний момент можно назвать фемтосекундный лазер, эпимикрокератом и эксимерлазерную коррекцию пресбиопии. Эти новинки появились не в прошлом и не в позапрошлом году, но их внедрение в клиническую практику начинается только сейчас.
Фемтосекундный лазер
Фемтосекундный лазер позволяет формировать роговичный лоскут без применения микрокератома, а также внутрироговичные каналы для имплантации интракорнеальных колец.
Преимущество перед микрокератомом заключается в ПОЧТИ бесконтактном проведении манипуляции, отсутствии необходимости создания вакуума, способствующего повышению внутриглазного давления до 50 мм рт. ст., и повышенном контроле за процессом формирования роговичного лоскута.
Недостаток – очень высокая цена аппарата, сопоставимая со стоимостью эксимерного лазера, длительность проведения процедуры и менее гладкая поверхность роговичного ложа. Последние два фактора технически устранимы в процессе усовершенствования аппарата, но стоимость его в ближайшее время существенно не снизится. Три года назад считалось, что фемтосекундный лазер так и не войдет в широкую клиническую практику. Однако сейчас достаточно многие рефракционные клиники США приобрели аппарат и сделали его одним из основных аргументов в конкурентной борьбе. В России фемтосекундные лазеры появились в Москве и Чебоксарах.
Несмотря на минимальные преимущества фемтосекундного лазера перед микрокератомом, рост конкуренции на рынке рефракционных услуг может привести к повсеместному внедрению аппаратов в практику и в нашей стране. Правда, производители микрокератомов тоже не сдаются, постоянно совершенствуя свои изделия. Принципиального преимущества фемтосекундный лазер над микрокератомом пока не имеет.
Эпимикрокератомы
Названия у этих приборов могут быть разными, но суть одна. Достаточно большое количество пациентов с противопоказаниями к ЛАСИК (чаще всего это тонкая роговица) остается «неохваченным» современной рефракционной хирургией. Это и стало основной мотивацией в поисках метода, совмещающего в себе достоинства ФРК и ЛАСИК и не имеющего их недостатков. Компромиссом можно считать микрокератом, способный формировать роговичный лоскут толщиной около 50 мкм, состоящий только из эпителиального пласта роговицы. Метод называется ЭпиЛАСИК (EpiLASIK). Показания к нему пока только растут, но насколько он будет избавлен от недостатков ФРК (выраженный регресс рефракционного результата при средней и высокой аметропии, хейз – помутнение роговицы), покажет время. Его двумя безусловными преимуществами перед ФРК является сокращение периода дискомфорта после операции (не без помощи контактной линзы в первое время) и процесса заживления. А преимуществом перед ЛАСИК является возможность проведения коррекции даже при сверхтонкой роговице (но не при высокой аметропии).
Эксимерлазерная коррекция пресбиопии
Пресбиопия – возрастная дальнозоркость (см. главу 1). Попыток проведения хирургической коррекции пресбиопии предпринималось немало. Но все они наталкивались на две трудности. Первая – трудно улучшить зрение вблизи, не ухудшив зрение вдаль. Вторая – пресбиопия всегда прогрессирует, с каждым прожитым десятилетием прибавляя диоптрию и этим нивелируя эффект любой коррекции.
Сейчас с помощью использования точечной подачи лазерного луча пробуют превратить роговицу в мультифокальную линзу, то есть линзу с несколькими фокусами. Изображений на сетчатке формируется тоже несколько, и мозг выбирает из них то изображение, которое является более четким в данный момент. Надо посмотреть на что-то вблизи – мозг выбирает фокус, дающий более четкое изображение вблизи. Нужно посмотреть вдаль – мозг выбирает другое изображение, более подходящее к этой цели.
Достигается это различными алгоритмами персонализированной лазерной абляции. Есть идеи и ступенчатой роговицы, и дозированной децентрации зоны абляции. И многое другое. Насколько это будет эффективным и долговременным, покажут дальнейшие исследования.
Альтернативы ЛАСИК. Новые методы хирургической коррекции близорукости, дальнозоркости и астигматизма
Сейчас вопрос об альтернативе ЛАСИК возникает в основном при наличии противопоказаний к лазерной коррекции. Другие методы либо более рискованны, либо их результат менее прогнозируем, менее точен.
Аспирация прозрачного хрусталика (АПХ). Факичные и мультифокальные ИОЛ. Биоптические операции
При очень высокой близорукости или дальнозоркости делать ЛАСИК бессмысленно. Диоптрии уменьшатся, но их останется довольно много, и без очков пациент обходиться не сможет, хотя их оптическая сила существенно уменьшится.
Раз нет возможности изменить роговицу, то стоит подумать об изменении хрусталика. Просто уменьшить или увеличить оптическую силу хрусталика не получится. При любом повреждении наружной капсулы хрусталик мутнеет – развивается травматическая катаракта. Поэтому есть два выхода: либо удалить свой прозрачный хрусталик и на его место имплантировать искусственный (интраокулярную линзу – ИОЛ), либо поместить рядом со своим хрусталиком факичную ИОЛ. Операции, подобные первой, проводят при удалении катаракты. Но здесь удаляется, аспирируется (высасывается через микротрубочку) не мутный, а прозрачный хрусталик.
Терминология следующая.
Афакия – глаз без хрусталика (так делали раньше, сейчас только в тяжелых случаях).
Артифакия – глаз без своего хрусталика, но с искусственным.
Факичная ИОЛ – искусственный хрусталик, который ставится в глаз без удаления своего хрусталика.
Преимущества этих методик в том, что можно убрать практически любую степень близорукости или дальнозоркости, а при наличии торических ИОЛ – и астигматизма.
Недостаток, как и у любой другой полостной операции, в возможности серьезных осложнений. Конечно, риск в каждой клинике стараются свести к нулю, и это почти удается. Риск потерять глаз минимален. Основные возможные осложнения: инфекция (эндофтальмит), кровоизлияние (экспульсивная геморрагия, гемофтальм) и дистрофия (эпителиально-эндотелиальная дистрофия роговицы).
Даже при отсутствии осложнений при установке факичной ИОЛ часто со временем мутнеет свой хрусталик (факичная ИОЛ прикасается к капсуле естественного хрусталика, и хроническая микротравматизация приводит к катаракте).
При полной замене хрусталика пропадает способность к аккомодации, то есть пациент хорошо видит либо вдаль, либо вблизи. Выходом является имплантация мультифокальных ИОЛ, имеющих несколько фокусов, чтобы мозг сам выбирал фокус, подходящий данному моменту. Но каждый раз точно рассчитать оптическую силу ИОЛ и поставить ее идеально невозможно. Часто после таких операций остается небольшой «плюс», «минус» или астигматизм, не говоря уже об аберрациях высшего порядка. Повторная операция резко увеличивает риск осложнений, да и нельзя гарантировать второй раз точное рефракционное попадание. Поэтому в последнее время при значимых ошибках в оптической силе после имплантации ИОЛ стали проводить ЛАСИК. Такое сочетание назвали биоптикой.
Биоптика («би», «оптика») – изменение двух оптических сред – роговицы и хрусталика. В биоптическую хирургию теперь входят различные сочетания операций: ФРК + имплантация факичной ИОЛ, тангенциальная кератотомия + факоэмульсификация катаракты, ЛАСИК + аспирация прозрачного хрусталика с имплантацией мультифокальной ИОЛ. Много различных операций в различных комбинациях.
Предложено много методов проведения ЛАСИК + аспирация прозрачного хрусталика (или факоэмульсификации катаракты). Например, предложено сначала формировать роговичный лоскут, через несколько дней аспирировать хрусталик с имплантацией ИОЛ, а затем через месяц делать лазерную абляцию для удаления остаточного астигматизма. Такой подход снижает риск сместить ИОЛ во время лазерной коррекции (а именно во время наложения вакуумного кольца) и в то же время удалить не только врожденный, но и остаточный (появившийся в результате неточности подбора силы ИОЛ и др.) астигматизм. Впрочем, если ИОЛ не «болтается» в течение 3–6 месяцев после имплантации (нет рефракционных и аберрометрических колебаний), то и сдвинуть ее вакуумным кольцом невозможно. Поэтому проведение ЛАСИК через полгода после имплантации ИОЛ тоже оправдано и безопасно.
Проведение биоптической операции или только аспирации прозрачного хрусталика при хирургической коррекции близорукости высокой степени имеет один малоприятный нюанс. Высокий риск отслойки сетчатки в глазу с выраженной миопией после проведения полостной операции возрастает многократно, даже несмотря на проведение профилактической лазеркоагуляции сетчатки. Если есть противопоказания к лазерной коррекции и опасность возникновения осложнений при полостных операциях, то можно продолжать пользоваться очками или контактными линзами. Правда, кроме полостных операций есть еще и другая альтернатива ЛАСИК.
Интракорнеальные (внутрироговичные) линзы и кольца
Вместо того чтобы при тонкой роговице имплантировать линзу внутрь глаза, можно установить ее в толщу роговицы. Собственно говоря, тот же ЛАСИК, но после формирования роговичного лоскута не надо делать лазерную абляцию, а просто под лоскут положить специальную микролинзу. (На самом деле выкраивается не лоскут, а особенный карман в толще роговицы. Ход операции утрирован для простоты понимания.) Это при гиперметропии. При коррекции миопии невозможно положить отрицательную линзу вместо положительной. Накрывший ее роговичный лоскут нивелирует всю ее отрицательность.
Поэтому при коррекции миопии не имплантируют линзу, а вставляют кольцо по периферии роговицы. Поднятая кольцом периферия роговицы превращает переднюю поверхность из выпуклой, положительной, линзы в отрицательную.
Недостатками этого метода являются не очень высокая точность рефракционного эффекта и невозможность устранения астигматизма и аберраций высшего порядка. Но в плане безопасности он почти не уступает ЛАСИК. В последних научных работах зарубежных авторов для формирования роговичного тоннеля для интракорнеальных колец применяется фемтосекундный лазер. Подобные работы дают надежду, что со временем данный метод составит реальную конкуренцию ЛАСИК при коррекции близорукости и дальнозоркости у пациентов с тонкой роговицей.
Экскурс в офтальмологическую имплантологию
По материалам сайта Московского государственного института радиотехники, электроники и автоматики www.fcyb.mirea.ru (Имплантаты в офтальмологии. Бабушкина Н.А.)
Имплантаты в офтальмологии в основном используются в следующих целях.
1. Для исправления нарушений при рефракционных заболеваниях (миопия, гиперметропия, пресбиопия, астигматизм). Факичные рефракционные линзы, замена прозрачного хрусталика, внутрироговичные имплантаты и склеральные имплантаты.
2. Для хирургического лечения катаракты. Различные виды интраокулярных линз для замены хрусталика.
3. Поражения сетчатки (пигментный ретинит, макулодистрофия, тапеторетинальная абиотрофия, тяжелые поражения сетчатки при осложненной миопии высокой степени и др.). Электрические методы стимуляции.
Имплантация в рефракционной хирургии.
Первые попытки исправить рефракционные недостатки предпринимались более 200 лет назад. Эти процедуры, произведенные Tadini (1790) и Casannatta (1790), были направлены на видоизменение хрусталика и уменьшение переднезаднего размера глаза. Спустя 100 лет V. Fukala показал, что удаление прозрачного хрусталика при миопии высокой степени приводит к положительному результату. Но распространению этой рефракционной операции мешали частые осложнения – гнойная инфекция и отслойка сетчатки. По мнению же большинства изучающих историю этого вопроса, именно кератотомия при астигматизме, выполненная в 1885 г. норвежским офтальмологом L. Schiotz, является первой рефракционной операцией.
Все имплантаты для исправления рефракции глаза можно разделить на следующие группы.
Факичные линзы (PRL, Phakic Refractive Lens) – устанавливаются параллельно с живым хрусталиком.
ИОЛ, заменяющий живой хрусталик.
Склеральные имплантаты (SEBs, Scleral Expansion Bands).
Внутрироговичные кольца (ICR, Intra Corneal Ring).
На сегодняшний день существует около 1500 моделей ИОЛ, изготавливаемых более чем 30 компаниями по всему миру.
В лечении пресбиопии лидируют две технологии – дополнительные склеральные сегменты, или склеральные имплантаты (SEBs, Scleral Expansion Bands) и факичные пресбиопические ИОЛ.
Внутрироговичные кольца (см. выше). Принципиальным отличием этой операции по замыслу авторов является обратимость метода. Имплантат можно удалить, если требуется коррекция зрения или есть неудовлетворенность роговичными кольцами.
Телескопические ИОЛ. Существует заболевание сетчатки – возрастная макулодистрофия (ВМД), которое приводит к потере центрального зрения и искажениям геометрии воспринимаемого изображения, а также полной потере зрения. Для коррекции изображения используют специальные телескопические очки, лупы и видеоувеличители текстов.
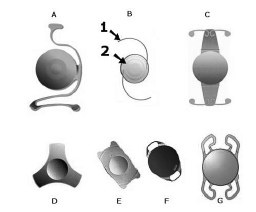
Рис. 18.
Некоторые модели интраокулярных линз (ИОЛ) и различные формы гаптики
1 – гаптика (крепление), 2 – оптическая часть (линза). А – переднекамерная факичная линза; B,C,G – линзы для замены хрусталика (помещаются в капсулу хрусталика); B,D,E – заднекамерные факичные линзы; F – линза для закрепления на радужке.
Использование аккомодирующих ИОЛ. Фронтальная оптическая часть ИОЛ Synchrony, обладающая большей оптической силой, способна к трехмерному движению – более интенсивному в переднезаднем направлении, и менее – под углом, тангенциальным оптической оси глаза. Осевое движение – основа изменения рефракции, однако тангенциальный сдвиг передней линзы может приводить к изменению градиента рефракции оптики, что способствует увеличению глубины фокуса и улучшает зрение вблизи.
Перспективы ИОЛ. В будущем количество различных моделей ИОЛ будет только увеличиваться. Уже сейчас существуют линзы с хромофорным веществом, выполняющим роль желтого светофильтра. Это необходимо для защиты сетчатки от вредного ультрафиолетового излучения, которое в здоровом глазе частично задерживает живой хрусталик. Также в ИОЛ внедряют микродатчики для контроля внутриглазного давления. Но основные усилия будут направлены на устранение основных минусов ИОЛ: глэр-эффекта, оптических аберраций, потерю аккомодации и появления светящихся ореолов вокруг ярких источников света. Оптические аберрации пропорциональны толщине линзы, поэтому будущие ИОЛ будут очень тонкими.
Недавно компанией Medennium была изобретена линза Smart Lens. Эта ИОЛ способна изменять свою форму при температуре тела от твердого стержня до сферичного гелеподобного аккомодирующего хрусталика, который полностью заполняет капсулярную сумку. В настоящий момент это устройство по свойствам наиболее приближено к естественному хрусталику. Их можно делать на заказ, используя данные магнитно-резонансного изображения о точном размере капсулярной сумки, и имплантировать через разрез размером всего лишь 1,0 мм.
В будущем также появится возможность моделирования оптической силы линзы в послеоперационный период.
Благодаря чересчур оптимистичному освещению со стороны СМИ наибольшим количеством мифов окружена работа ученых по разработке электрических имплантатов. И это не удивительно. На сегодняшний день электрические имплантаты являются наиболее перспективным направлением для лечения необратимой слепоты. Поражения сетчатки и зрительного нерва сейчас рассматриваются как приговор – восстанавливать такое количество погибших нервных клеток человечество пока не научилось. А развитие электрических имплантатов дает надежду на преодоление слепоты.
На сегодняшний день существует около 15 групп ученых по всему миру, занимающиеся практическими исследованиями и разработками искусственных сетчаток.
Схема работы электрических имплантатов искусственной сетчатки следующая.
Фотодетектор преобразует свет в электрический сигнал. Преобразователь (микропроцессор) перекодирует полученный электрический сигнал в такую последовательность импульсов, которая может быть воспринята нейронами. Электроды, получив сигнал от преобразователя, стимулируют нейроны, тем самым вызывая потенциалы действия и дальнейшую передачу информации в нервные центры.
По размещению фотодетекторы различают:
внутренний (матрица фотодетекторов, устанавливаемая на глазное дно);
внешний (камера, устанавливаемая в специальные очки).
Физически преобразователь является микропроцессором, поэтому должен снабжаться энергией. Энергии света недостаточно, чтобы подпитывать преобразователь и электроды, поэтому должен быть внешний возобновляемый источник энергии. Такой источник располагается вне организма человека и питается от аккумуляторов. Передача же энергии осуществляется беспроводным путем на основе электромагнитной индукции: для этого на «ушках» специальных очков размещают передающую катушку, а в склеру глаза имплантируют принимающую катушку, соединенную с микросхемами и электродами. Это не относится к технологии ArtificalSiliconRetina (ASR), где преобразователя нет вообще, а стимуляция электродами производится за счет энергии света. Artifical Silicon Retina представляет собой силиконовый чип диаметром 2 мм и толщиной 25 мкм, на котором размещаются 5000 электродов. К каждому электроду подключен фотодиод, преобразующий свет в электроимпульсы, которые затем передаются клеткам сетчатки. Чип питается только от энергии света и не требует внешних источников питания. Доклинические испытания показали наличие сигналов на электроретинограмме (ЭРГ) и иногда визуально-вызванных потенциалов (VEPs) в мозге.
По месту размещения электродов различают:
эпиретинальную технологию (EPI-RET). В эпиретинальной технологии электроды размещаются над сетчаткой и стимулируют ее ганглиозные клетки;
субретинальную технологию (SUB-RET). Субретинальная технология предполагает размещение электродов между пигментным слоем и рецепторами сетчатки;
размещение имплантатов у зрительного нерва. Группа ученых в рамках европейского проекта MIVIP (Microsystems Based Visual prosthesis) изучает стимулирование электродами непосредственно зрительного нерва. Протез включает в себя внешнюю камеру, нейростимулятор в титановом корпусе со спиральным электродам в виде манжетки и интерфейс для передачи информации и энергии посредством радиоволн. Электрод вживляется за глазным яблоком в свободное место, где зрительный нерв не покрыт мозговой оболочкой, которая ослабила бы стимулирование;
размещение имплантатов в зрительных зонах коры головного мозга. Исследования по внедрению систем искусственного зрения в зрительную зону коры больших полушарий ведутся с 1960-х годов. Вся система протеза представляет собой наружную камеру, преобразователь, набор электродов и интерфейс для передачи информации и энергии беспроводным путем. Нейростимулятор представляет собой матрицу игольчатых электродов из биосовместимых материалов: Si или IrOx. Кремний предпочтительнее, так как в него можно встраивать микропроцессорные элементы. Мозг – вязкоупругий материал, поэтому внедрение электродов должно быть очень быстрым (1 м/c). Иначе возникают повреждения сосудов и деформация корковой поверхности. Электроды устанавливаются в первичной зрительной коре (зона V1, или 17 поле по Бродману).
Офтальмология не стоит на месте. Каждый год появляются новые решения. Развитие химии, электроники и компьютерных технологий позволяет сегодня использовать высококачественные имплантаты для устранения последствий различных глазных заболеваний. Несмотря на психологический барьер, который надо переступить человеку для согласия операции по вживлению имплантатов, а также многочисленные возможные осложнения, для многих людей имплантация – единственный шанс восстановить зрение и повысить свое качество жизни.
Date: 2015-10-18; view: 465; Нарушение авторских прав