
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Изменение скорости прямой и обратной реакций в процессе установления химического равновесия
|
|
Равновесными концентрациями называются концентрации всех веществ системы, которые устанавливаются в ней при наступлении состояния химического равновесия.
Равновесные концентрации веществ, выраженные в моль/л, принято обозначать квадратными скобками, между которыми указывается формула вещества.
Состояние химического равновесия имеет следующие особенности:
1. Динамический характер химического равновесия - прямая и обратная реакции не прекращаются, а протекают с равными скоростями.
2. Постоянство состояния химического равновесия во времени - при неизменных внешних условиях состав равновесной системы не меняется (равновесные концентрации постоянны).
3. Подвижность равновесия - при изменении внешних условий происходит смещение химического равновесия, т. е. установление новых равновесных концентраций всех реагирующих веществ.
4. Возможность подхода к состоянию равновесия с двух сторон - как со стороны исходных веществ, так и со стороны продуктов реакции.
В равновесной химической системе фактически нет ни реагентов, ни продуктов, так как все вещества и процессы их взаимодействия участвуют в создании равновесия. В таких системах вещества называются реагентами и продуктами только формально в соответствии с уравнением химической реакции.
С учетом того, что в основе химического равновесия лежит равенство скоростей прямой и обратной реакций, для количественной характеристики состояния химического равновесия в системе можно ввести новый безразмерный параметр - константу химического равновесия, которая равна отношению константы скорости прямой реакции к константе скорости обратной реакции: K =  /
/ 
Выведем, чему равна К процесса, протекающего в гомогенной системе:
аА + bВ ↔ dD + fF
В состоянии химического равновесия  =
= 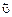
 [A]a[B]b =
[A]a[B]b =  [D]d[F]f
[D]d[F]f 
Константа химического равновесия обратимого процесса равна отношению произведения равновесных концентраций конечных продуктов к произведению равновесных концентраций исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам при формулах соответствующих веществ в уравнении химической реакции.
Так формулируется закон действующих масс для обратимых процессов.
Концентрации твердых веществ в гетерогенных системах не входят в выражение константы химического равновесия, так как они учитываются величинами константы скорости гетерогенной реакции:
2SO2(г) + O2(г) ↔ 2SO3(г)  =
=  [SO2]2[О2]
[SO2]2[О2] 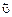 =
=  [SО3]
[SО3] 
С(т) + О2(г) ↔ СО2(г)  =
=  [О2]
[О2] 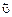 =
=  [CО2]
[CО2] 
Значение константы химического равновесия определяет положение равновесия, т. е. относительное содержание исходных веществ и конечных продуктов в системе, находящейся в равновесном состоянии.
Если K > 1, то в системе выше содержание конечных продуктов, т. е. положение равновесия смещено вправо (→). '
Если K < 1, то в системе выше содержание исходных веществ, т. е. положение равновесия смещено влево (←).
Константа химического равновесия, как и константа скорости реакции, зависит от природы реагирующих веществ и температуры, но не зависит от присутствия катализатора, поскольку он изменяет константы скоростей и прямой и обратной реакции в одинаковое число раз. Катализатор, увеличивая скорости прямой и обратной реакций, уменьшает время, необходимое для установления равновесия в системе.
Константа химического равновесия не зависит от концентраций реагирующих веществ и давления в системе, так как эти факторы не влияют на константы скоростей химических реакций.
Date: 2015-10-22; view: 1133; Нарушение авторских прав