
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическое равновесие. Химические реакции бывают необратимые и обратимые
|
|
Химические реакции бывают необратимые и обратимые.
Необратимыми называются реакции, которые протекают только в одном направлении до полного израсхо дования одного из реагирующих веществ.
Необратимыми являются, например, взаимодействие активных металлов с кислородом, водой, кислотой или термическое разложение сложных веществ:
2Са + О2 → 2СаО Са + H2SО4(paзб.) → CaSО4 + H2↑
2KMnО4 → K2MnО4 + MnО2 + О2↑ Ca + 2H2О → Ca(OH)2 + H2↑
4Ca + 5H2SО4(конц.) → 4CaSО4 + H2S↑ + 4H2О NH4NО3 → 2H2О + N2О↑
Однако в природе необратимых реакций меньше, чем обратимых, которые лучше называть обратимыми процессами.
Обратимыми называются процессы, в которых одновременно протекают две взаимно противоположные реакции - прямая и обратная.
Примером обратимых процессов являются реакции образования и разложения йодоводорода или сложного эфира:
СН3СООН + С2Н5ОН ↔ СН3СООС2Н5 + Н2О H2 + I2 ↔ 2HI
 В таких химических системах при определенных условиях одновременно протекают как прямая, так и обратная реакция. При этом в результате каждой реакции образуются исходные вещества, необходимые для осуществления противоположной реакции, причем уменьшение скорости одной реакции сопровождается увеличением скорости обратной реакции до тех пор, пока скорости обеих реакций не станут равными. Следовательно, в этих случаях в системе без каких-либо внешних воздействий происходят взаимообратные химические превращения, которые приводят систему в устойчивое равновесное состояние, характеризующееся равенством скоростей прямой и обратной реакции (
В таких химических системах при определенных условиях одновременно протекают как прямая, так и обратная реакция. При этом в результате каждой реакции образуются исходные вещества, необходимые для осуществления противоположной реакции, причем уменьшение скорости одной реакции сопровождается увеличением скорости обратной реакции до тех пор, пока скорости обеих реакций не станут равными. Следовательно, в этих случаях в системе без каких-либо внешних воздействий происходят взаимообратные химические превращения, которые приводят систему в устойчивое равновесное состояние, характеризующееся равенством скоростей прямой и обратной реакции ( =
= 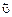 ).
).
Химическим равновесием называется такое состояние обратимого процесса, при котором скорости прямой и обратной реакций равны.
Состояние химического равновесия в любой системе характеризуется постоянством параметров, описывающих эту систему. Поэтому в системе, где протекает обратимый процесс, в состоянии химического равновесия наблюдается не только равенство скоростей взаимно противоположных реакций, но и постоянство равновесных концентраций исходных и конечных веществ.
Date: 2015-10-22; view: 539; Нарушение авторских прав