
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Характеристика доступов в хирургии рака пищевода
|
|
При локализации опухоли в шейной части для повышения онкологического радикализма одновременно обычно выполняют ларингоэктомию и резекцию дистального отдела глотки. Фаринголарингоэзофагэктомию завершают пластикой пищевода с помощью различных кожно-мышечных лоскутов.
Операции по поводу рака грудного отдела пищевода подразделяются на два типа: резекция пищевода по Доборосмыслову-Тореку и субтотальная эзофагэктомия по Льюису. В случае резекции линия пересечения пищевода делается на расстоянии 4-6 см от верхнего края опухоли. Субтотальная эзофагэктомия предусматривает почти полное (за исключением шейного отдела), на 8 и более сантиметров выше края опухоли, удаление пищевода независимо от локализации опухоли.
В случае резекции пищевода пищеводный анастомоз, как правило, располагается внутриплеврально, а в случае субтотальной эзофагэктомии - только внеплеврально (на шее).
В зависимости от выбора оперативных вмешательств выделяют следующие основные виды вмешательств:
1) чресплевральные (право- или левосторонняя торакотомия) в сочетании с диафрагмо- или лапаротомией;
2) комбинированные торакоабдоминальные;
3) трехдоступные (торакотомия, лапаротомия и цервикотомия);
4) трансхиатальные (так называемые операции без торакотомии).
Выбор оптимального оперативного доступа является в высшей степени важной проблемой в хирургии рака пищевода. Правильный доступ позволяет хирургу в комфортных условиях выполнять резекционный и пластический этапы вмешательства. Существует также дополнительное требование к доступу - обеспечение возможности адекватного удаления регионарных лимфатических коллекторов в пределах фасциальных структур.
Правосторонняя торакотомия. Операция приобрела значительное распространение с 1946 года, когда Льюис впервые выполнил резекцию пищевода с опухолью и внутриплевральную пластику пищевода желудком. Она показана при раке средней и нижней трети пищевода. Выполняется субтотальная эзофагэктомия из лапаротомного и правостороннего торакотомного доступа (рис. 63). Пластика широким желудочным стеблем с формированием пищеводного соустья в куполе правой плевральной полости, с 2-х или 3-х зональной расширенной лимфодиссекцией.

| Этап I Положение на спине для лапаротомии и первого (абдоминального) этапа операции резекции и пластики пищевода по Льюису | |
 Линия для выделения большой кривизны желудка с сохранением сосудистых аркад
Линия для выделения большой кривизны желудка с сохранением сосудистых аркад
|  Выделение желудка налево до полного пересечения желудочно-ободочной связки
Выделение желудка налево до полного пересечения желудочно-ободочной связки
| |
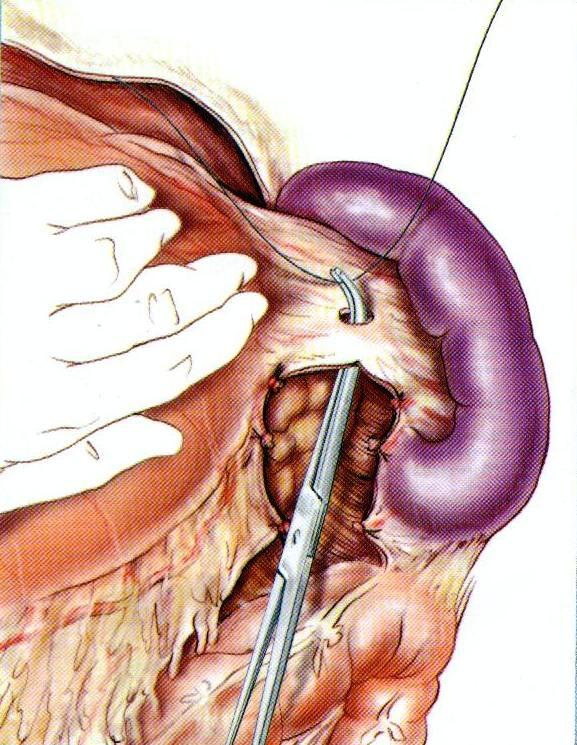 Лигирование элементов ножки селезенки
Лигирование элементов ножки селезенки
|  Раздельное лигирование левой желудочной артерии и вены
Раздельное лигирование левой желудочной артерии и вены
| |
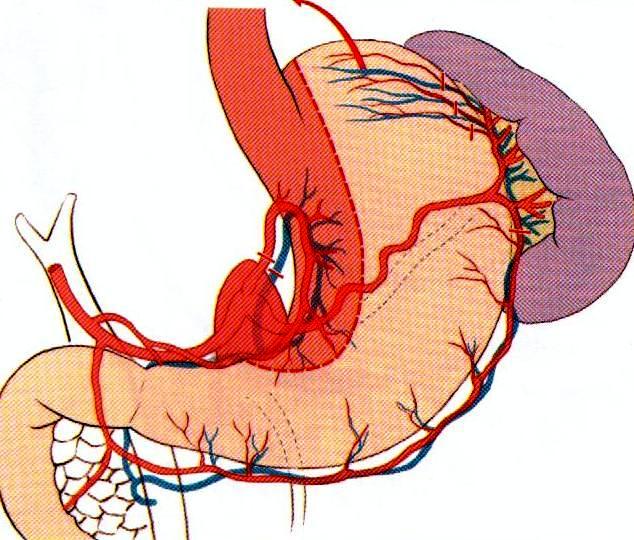 Широкая желудочная трубка
Широкая желудочная трубка
|  Узкая желудочная трубка
Узкая желудочная трубка
| |
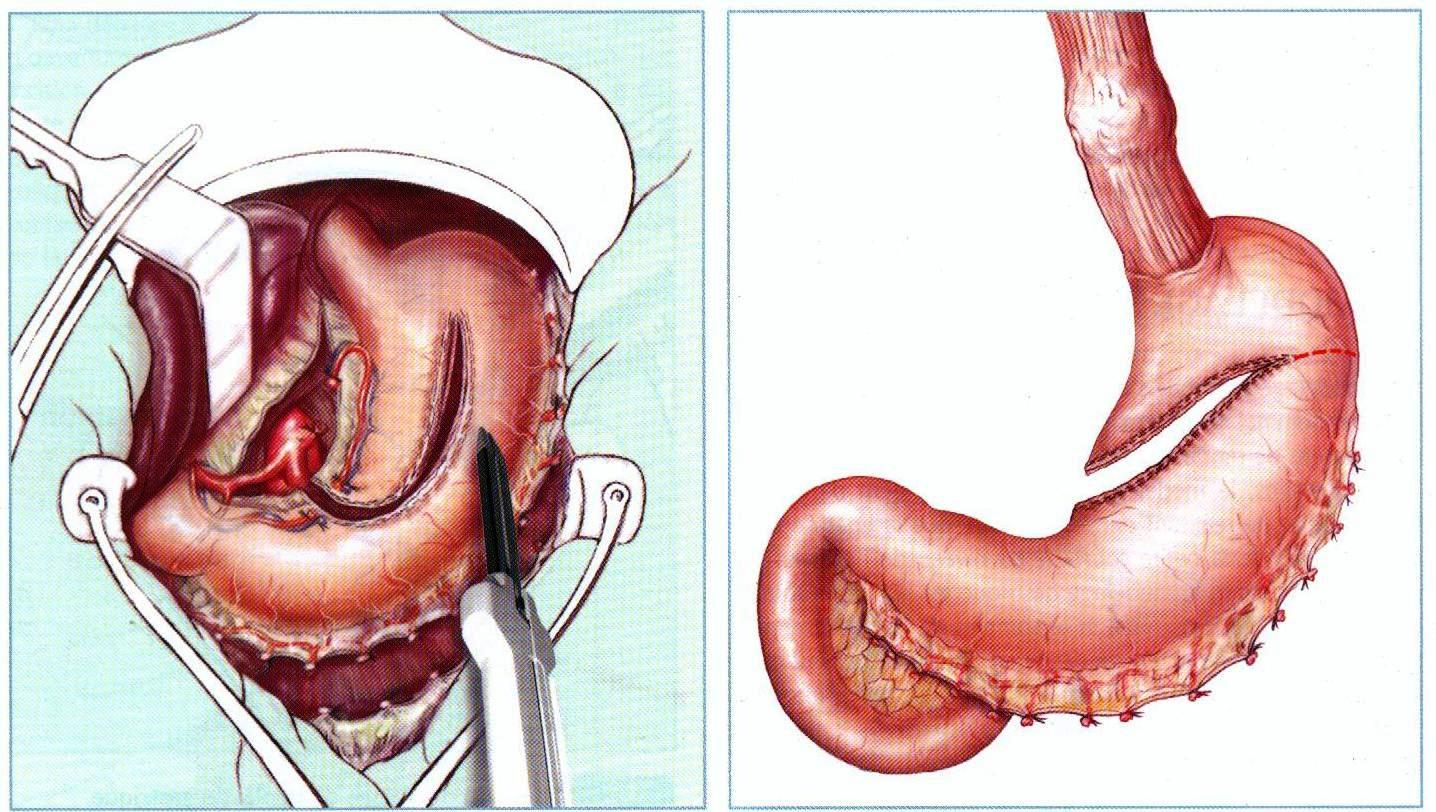  а б
а – иссечение большой кривизны желудка с выходом к месту окончания сосудистых аркад; б – варианты выбора: пилоропластика, перитонезация скобок
(окончание рассечения желудка проводится при торакальном этапе операции)
а б
а – иссечение большой кривизны желудка с выходом к месту окончания сосудистых аркад; б – варианты выбора: пилоропластика, перитонезация скобок
(окончание рассечения желудка проводится при торакальном этапе операции)
| ||

| Этап II Изменение позиции для проведения правой торакотомии и второго (торакального) этапа операции резекции и пластики пищевода по Льюису | |
 Рассечение плевры у нижней части пищевода
Рассечение плевры у нижней части пищевода
|  Иссечение из средостенья пищевода и прилежащей клетчатки с лимфоузлами
Иссечение из средостенья пищевода и прилежащей клетчатки с лимфоузлами
| |
 Выведение трансплантата, завершение подготовки к пересечению пищевода
Выведение трансплантата, завершение подготовки к пересечению пищевода
| 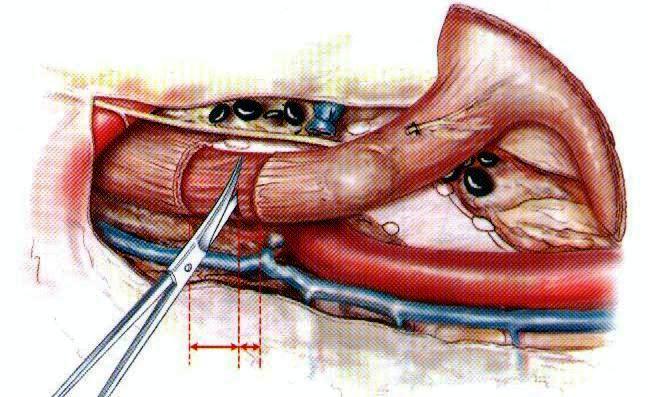 Раздельное послойное рассечение пищевода у верхушки грудной полости
Раздельное послойное рассечение пищевода у верхушки грудной полости
| |
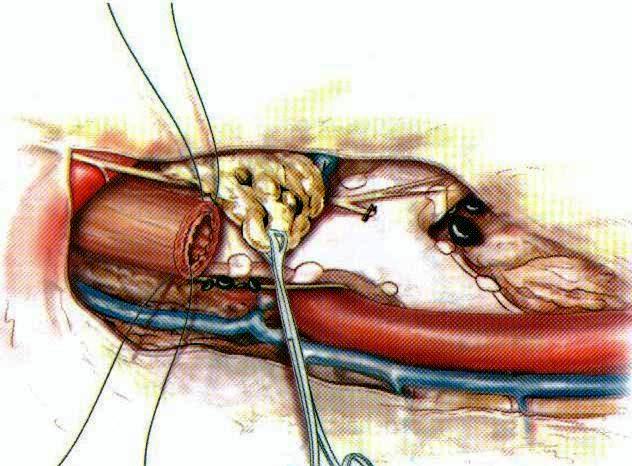 Лимфодиссекция ложа Баретти (пространство между трахеей и полой веной)
Лимфодиссекция ложа Баретти (пространство между трахеей и полой веной)
|  Рассечение желудка на расстояние от линии скобок
Рассечение желудка на расстояние от линии скобок
| |
 Натяжение стенки пищевода перед наложением швов, шов на пищеводе через все слои, на желудке без слизистой
Натяжение стенки пищевода перед наложением швов, шов на пищеводе через все слои, на желудке без слизистой
| ||
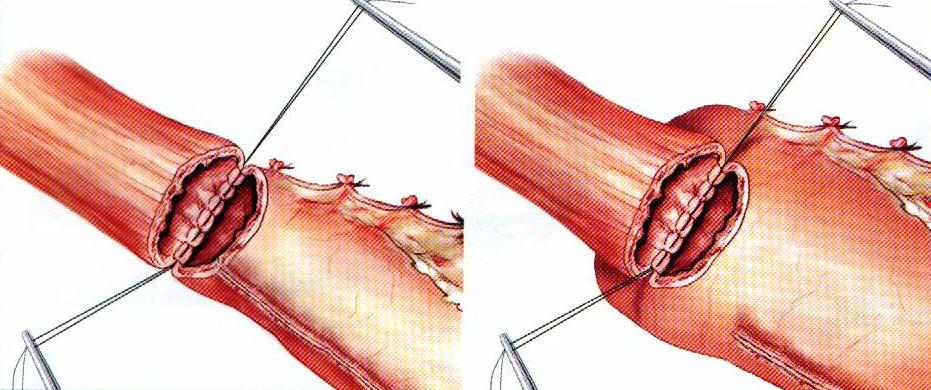 В случае узкого желудочного трансплантата наложение анастомоза конец в конец
В случае узкого желудочного трансплантата наложение анастомоза конец в конец
| ||
 П- образные швы выше анастомоза в случае небольшого натяжения
П- образные швы выше анастомоза в случае небольшого натяжения
| 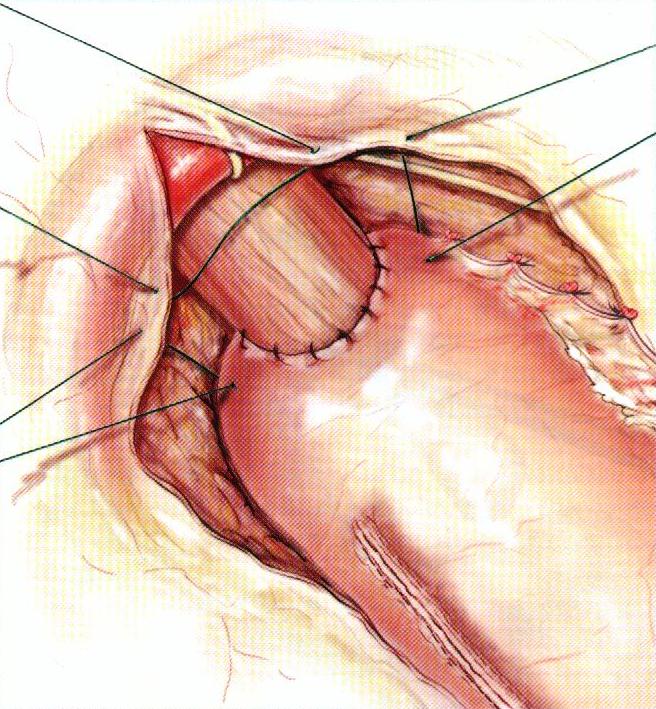 «Подвешивающие» швы с медиастинальной плеврой
«Подвешивающие» швы с медиастинальной плеврой
| |
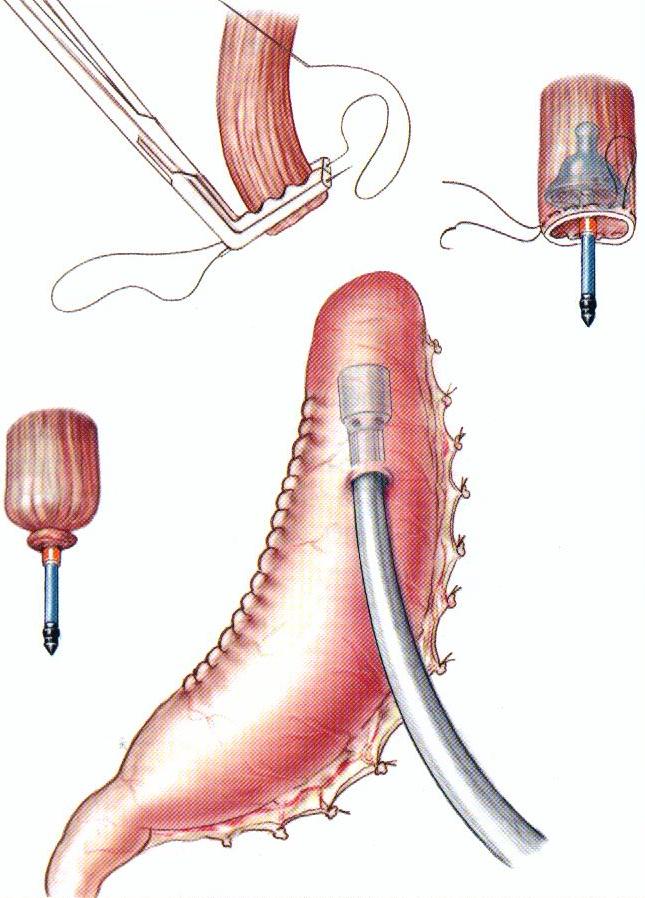 Механический анастомоз
Механический анастомоз
|  Вид после наложения механического анастомоза: ушито отверстие в кардии после введения аппарата
Вид после наложения механического анастомоза: ушито отверстие в кардии после введения аппарата
| |
Рис. 63. Абдоминальный и торакальный этапы операции резекции пищевода с опухолью и внутриплевральной пластики пищевода желудком по Льюису (субтотальная эзофагэктомия из лапаротомного и правостороннего торакотомного доступа).
В последние 2-3 десятилетия операция Льюиса стала почти доминирующей во многих клиниках. Преимущества правосторонней торакотомии обусловлены анатомически: начинать операцию нужно со средней части внутригрудного отдела пищевода, расположенного по правую сторону от грудной аорты, которая делает его целиком доступным со стороны правой плевральной полости. После этих операций летальность в разных авторов разная: от 1,8 до 26,2%, хотя в последние годы в большинстве клиник она все же не превышает 5-6%.
Переднебоковая торакотомия. Важным недостатком правосторонней торакотомии является невозможность из этого доступа достичь органов брюшной полости (этому препятствует печень). Возникает необходимость делать дополнительную лапаротомию, в ходе которой осуществляется мобилизация желудка. С целью уменьшения продолжительности операции делаются попытки классическую правостороннюю заднебоковую торакотомию заменить переднебоковой торакотомией в положении больного лежа на спине, которая дает возможность одновременно двумя бригадами хирургов выполнять и торакотомию, и лапаротомию (синхронные операции).
Левосторонняя торакотомия. Данная операция была первым трансплевральним доступом, через который удалось выполнить радикальную экстирпацию внутригрудного пищевода с опухолью (Торек, 1913). Этот доступ имеет преимущество, так как обеспечивает возможность обратиться к диафрагмотомии без лапаротомии, что делает возможным манипуляции и на органах верхнего этажа брюшной полости. Серьезным недостатком левосторонней торакотомии является то, что расположение дуги аорты впереди и по левую сторону от пищевода ухудшает условия для мобилизации средней и верхней частей пищевода, а также - для наложения высокого анастомоза. Левосторонняя торакотомия одновременно с диафрагмотомией имеет много приверженцев, похоже, что их больше, чем приверженцев правосторонней торакотомии. Некоторые хирурги в таком случае формируют внутригрудные анастомозы на уровне или выше дуги аорты, располагая их спереди от неё. Однако продолжительность таких операций значительно превышает продолжительность операций по Льюису.
Комбинированный левосторонний торакоабдоминальний доступ в сочетании с полной или частичной диафрагмотомией. Данный подход давно признан методом выбора в случае опухолей кардиоэзофагеальнои зоны. Доступ имеет важные преимущества перед простой левосторонней торакотомией в случае опухолей нижней части пищевода. Дополнительная лапаротомия значительно расширяет зону действий хирурга и потому облегчает процесс мобилизации не только желудка, но и пищевода. Левосторонняя торакотомия в сочетании с диагональной лапаротомией и полной диафрагмотомией обеспечивает идеальные условия для мобилизации нижних отделов пищевода и желудка с соблюдением принципов радикализма и для формирования пищеводного анастомоза.
Использование трех доступов. В последние годы ряд клиник прибегает к использованию трех доступов - правосторонней торакотомии, верхнесрединной лапаротомии и цервикотомии.
Во-первых, многие считают, что для рака пищевода характерен мультицентричний рост. Поэтому операцию типа Льюиса или резекцию пищевода, при которой пищевод пересекается на уровне его средней или верхней трети и анастомоз располагается ниже верхней апертуры грудной клетки, они характеризуют как сознательно паллиативную, даже в случае рака нижней трети органа. Из этих позиций преимущество предоставляется субтотальний эзофагэктомии, что требует формирования шейного эзофагоанастомоза.
Во-вторых, возрос интерес к метастазам в регионарные лимфоузлы. Уже 15-20 лет японские хирурги стремятся к наиболее полному удалению всех возможных лимфатических узлов, считая, что даже макроскопические неизмененные лимфоузлы могут содержать опухолевые клетки. Установлено, что при наличии раковой опухоли в средней и верхней третях пищевода чаще всего бывают метастазы в лимфоузлы по ходу поворотного нерва, лимфоузлы вдоль главных бронхов и в парааортальной клетчатке. В случае рака дистальных отделов пищевода и кардии метастазы выявляются в лимфоузлах нижнего средостения, поддиафрагмальных лимфоузлах и лимфоузлах вдоль малой кривизны желудка. В связи с этим приверженцы широкой лимфодиссекции избрали наиболее оптимальной операцией эзофагэктомию с помощью 3 доступов: торакального, абдоминального и цервикального. Эти три доступа, по их мнению, дают возможность наиболее полно и методически удалить весь регионарный лимфатический аппарат, который потенциально содержит опухолевые клетки.
В-третьих, некоторые хирурги небезосновательно утверждают о значительно большей безопасности подобных операций, поскольку невозможность анастомоза, расположенного на шее, а не внутриплеврально, теряет свой фатальный характер.
Сегодня применяются две методики цервикотомии. Простая цервикотомия используется только для формирования шейного анастомоза. Двусторонняя цервикотомия преследует цель не только создания анастомоза, но и осуществления шейной лимфаденэктомии.
По данным одних исследователей, расширенная лимфодиссекция существенным образом улучшает прогноз, повышая пятилетнее выживание с 25-30% до 50-70%. Другие авторы указывают, что расширенная лимфодиссекция улучшает результаты только у больных с относительно небольшим количеством регионарних метастазов. На ранних стадиях рака или в случае запущенного процесса расширенная лимфодиссекция преимуществ не имеет. Некоторые специалисты вообще сомневаются в достоверности полученных положительных результатов и высказываются против преждевременных категоричных заявлений в пользу широкой лимфодиссекции.
Эти сомнения подкрепляются и соображениями другого плана. Расширенная лимфодиссекция тремя доступами приводит к увеличению частоты послеоперационных осложнений более чем в два раза. Это связано с тем, что повышается продолжительность кровопотери, внутриплевральной лимфореи и экссудации, увеличивается риск развития гнойных осложнений.
Одним из наиболее частых (45% больных) неблагоприятных последствий шейной лимфодиссекции является нарушение функций гортани и глотки в результате повреждения поворотных нервов. Паралич поворотных нервов способствует повышению количества легочных осложнений и очень ухудшает отдаленные результаты: у больных наблюдаются нарушения функции глотания и языка, которые могут длиться много месяцев и даже годы.
Отрицательным моментом этих операций также служит и проблема шейного пищеводного анастомоза. Хотя его несостоятельность и не является таким тяжелым осложнением, как несостоятельность внутригрудного анастомоза, но частота такого осложнения очень большая (до 65%).
В связи с этим разрабатываются дополнительные меры, направленные на повышение надежности анастомоза, а некоторые хирурги параллельно с наложением шейного эзофагогастроанастомоза даже вынуждены накладывать дополнительную еюностому, чтобы обеспечить запасной путь питания больного.
Трансхиатальная эзофагэктомия. Доступ к пищеводу без торакотомии, в силу меньшей травматичности, всегда интересовал хирургов. Еще в 1913 году Денк разработал трансхиатальную эзофагэктомию, что предусматривало выполнение лапаротомии с диафрагмотомией и цервикотомии. Мобилизация пищевода осуществляется как снизу, через рассеченную диафрагму, так и сверху, через разрез на шее. После мобилизации пищевод вытягивается на шею вместе с желудком, который трансплантируется, после чего осуществляется удаление пищевода и формирование пищеводного анастомоза.
В России приоритет этой операции всегда отдавался А.Г.Савиных, который с 40-х годов начал использовать упрощенную модификацию операции в случае кардиоэзофагеального рака, выполняя лишь лапаротомию и диафрагмотомию.
Сегодня трансхиатальная эзофагэктомия по методике Денка имеет огромное количество приверженцев. Чаще всего ее выполняют по поводу рака кардии и нижней части пищевода. Большинство авторов утверждают, что, по сравнению с торакальным или торакоабдоминальным доступами, в этом случае снижается травматичность операций. Особенно обращается внимание на преимущества операции у ослабленных и пожилых пациентов, а также при наличии у больных легочной патологии.
Трансхиатальная эзофагэктомия с хорошими результатами применяется и в случае рака более высоких отделов пищевода. Для сокращения времени операции даже была разработана технология, при которой две отдельные бригады хирургов работают одновременно в цервикальной зоне и в брюшной полости.
Однако преимущества трансхиатального доступа признаются далеко не всеми. Некоторые хирурги считают, что в случае рака средней трети следует прибегать к торакотомии, а к трансхиатальному доступу - лишь у больных с сопутствующей патологией со стороны органов дыхания. Другие опытные специалисты вообще сомневаются в возможности выполнения подобных операций, если их проводить с соблюдением всех онкологических принципов.
Кроме того, тупое выделение пищевода всегда связано с риском интраоперационных осложнений, к которым относят: раскрытие одной или обеих плевральных полостей, повреждение бронхов и тяжелые, временами летальные, кровотечения через разрывы непарной вены, разрывы аортальных ветвей. По данным некоторых хирургов, не менее 5% больных в ходе таких операций нуждаются в срочной торакотомии.
На согласительной конференции ISDE (1995 год) было установлено, что трансхиатальную резекцию выполняют в основном хирурги общего профиля, а трансторакальную резекцию - хирурги-онкологи.
Трансторакальный доступ возможен в двух вариантах: справа (в сочетании со срединной лапаротомией) или слева (как правило, в виде тораколапаротомии в VI межреберье по Осаве-Гарлоку). Это отнюдь не равнозначные доступы в отношении как уровня резекции пищевода, так и возможности выполнения лимфодиссекции в средостении.
Наиболее оптимальным и соответствующим требованиям онкологической абластики при раке грудного отдела пищевода следует признать комбинированный лапаротомный и правосторонний торакотомный доступы по Льюису, который при необходимости можно дополнить шейным разрезом (цервикотомией).
Доступ позволяет:
1) осуществить широкий обзор операционного поля;
2) безопасно мобилизовать грудной отдел пищевода на всем протяжении, при этом выполнить лимфодиссекцию в любом объеме и, в случае необходимости, произвести резекцию смежных органов, сохранить легочные ветви блуждающего нерва (крайне важная деталь для профилактики послеоперационных дыхательных нарушений);
3) надежно сформировать пищеводный анастомоз в верхней апертуре грудной клетки, где имеются хорошие условия для нормального функционирования соустья, а также соблюсти при раке средне- и нижнегрудного отделов положенную границу проксимальной резекции - минимум 8 см выше уровня опухоли.
При хирургическом лечении рака шейного отдела пищевода с успехом используется цервикотомия. Наиболее проблематичными являются опухоли пищевода на границе шейного и внутригрудного отделов органа. Для доступа к этой зоне предложено несколько нестандартных доступов: 1) цервикотомия, дополненная резекцией грудино-ключичного сочленения и резекцией первого реберного хряща;2) двусторонняя цервикотомия с продольной стернотомией.
Date: 2015-10-18; view: 1967; Нарушение авторских прав