
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Геохимия изотопов в историко-геологических исследованиях
|
|
Изучение рядов распада радиоактивных элементов привело к открытию изотопов. Название «изотоп» было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих слов: isos – одинаковый и topos – место. Геохимия изотопов открыла новые страницы истории элементов земной коры (рис.5.3). Многие закономерности, которые раньше строились на основе косвенных признаков, получили точные обоснования с мерой и числом.
 Наряду с радиоактивными изотопами, распадающимися в результате естественных ядерных процессов, были обнаружены и стабильные, не изменяющиеся за все время существования нашей планеты.
Наряду с радиоактивными изотопами, распадающимися в результате естественных ядерных процессов, были обнаружены и стабильные, не изменяющиеся за все время существования нашей планеты.
Рассмотрим вариации соотношений некоторых стабильных изотопов, наиболее важных в геохимическом отношении (углерод, кислород и сера).
Углерод. Изотопный состав углерода природных объектов определяется присутствием двух стабильных изотопов — 12С и 13С — и ничтожно малых количеств С14, являющегося радиоактивным с периодом полураспада 5730 лет. Соотношение 12C/13C варьирует в природных объектах от 88 до 91.
 Какие же вариации С13 существуют в природе, и какие процессы ответственны за происходящее разделение изотопов? Значения 13С морских известняков варьирует от + 4,5 до -5,1‰. Доломиты имеют несколько более тяжелый углерод по сравнению с обычными кальцитами. Все остальные значения, в том числе и метеоритные, лежат правее, в отрицательной области. Это связано с тем, что живые организмы активно дифференцируют изотопы углерода, используя для построения своих скелетов более тяжелый изотоп 13С, а для мягких тканей легкий 12С.
Какие же вариации С13 существуют в природе, и какие процессы ответственны за происходящее разделение изотопов? Значения 13С морских известняков варьирует от + 4,5 до -5,1‰. Доломиты имеют несколько более тяжелый углерод по сравнению с обычными кальцитами. Все остальные значения, в том числе и метеоритные, лежат правее, в отрицательной области. Это связано с тем, что живые организмы активно дифференцируют изотопы углерода, используя для построения своих скелетов более тяжелый изотоп 13С, а для мягких тканей легкий 12С.
Процесс разделения изотопов начинается с фотосинтеза, который приводит к заметному обогащению органического вещества легким углеродом 12С. Самые низкие величины дает природный газ (до -105‰.). Причиной такого изотопного состава углерода метана в газах является еще один процесс, широко распространенный в земной коре. Это микробиологическое фракционирование изотопов углерода, метаболизм бактерий, приводящих к образованию исключительно легкого метана.
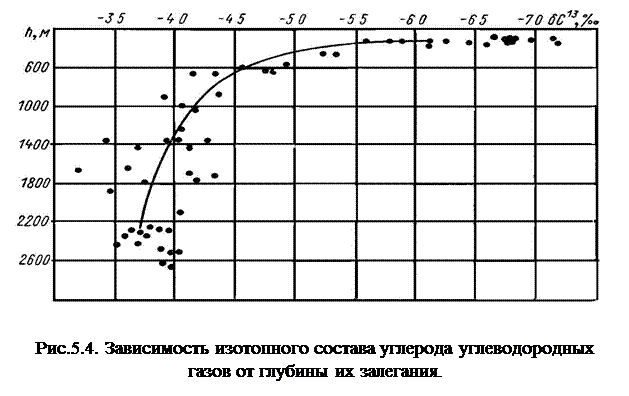
Однако с увеличением температуры в земных недрах между метаном, освобождающимся при метаморфизме органического вещества, и углекислотой, выделяющейся при разложении карбонатов, протекает обменная реакция; причем, чем выше температура, тем больше будут выравниваться содержания изотопов в обоих соединениях, т. е. тем меньше метан будет обогащаться изотопом 12С. Наглядное доказательство этому дает рисунок 5.4, где показана распространенность 13С в метане на различной глубине. На основе изложенного можно сделать вывод, что фракционирование углерода в Земле вне зависимости от характера его первичного изотопного состава обусловлено главным образом биогенными явлениями. Механизм распределения изотопов углерода настолько тонок и неповторим, что в составе любого организма могут наблюдаться различные смеси изотопов углерода в разных его органах, которые не могут быть искажены посторонними процессами.
| Таблица 5.2. Распространенность изотопов кислорода. | |
| 16О | 99,759 |
| 17О | 0,0371 |
| 18О | 0,2039 |
Кислород представлен в природе тремя изотопами. Данные об их распространенности приведены в табл. 5.2. Изотоп 18О образует максимально устойчивую замкнутую ядерную систему (Z=N=8). Согласно теории ядерного синтеза, кислород возник в результате гелиевого сгорания по схеме:
12С + 4Не = 16О
Практически изучено отношение 18О/16О, которое в природных объектах изменяется на 10% - от 1/475 до 1/525. При сравнении измерений изотопного состава кислорода пользуются величиной d 18О ‰. За стандарт принято среднее соотношение 18О/16О в океанической воде. Величина 10% указывает, что газ содержит на 1‰ больше 18О чем стандарт.
Г.Юри в 1947 г впервые указал, что вариации изотопного состава кислорода в земных объектах (горных породах, воде) определяются в первую очередь температурой, при которой протекает тот или иной процесс, а следовательно могут быть использованы в качестве геологического термометра. Распределение изотопов кислорода между кислородсодержащими компонентами системы характеризуется константой равновесия (К), которая находится в обратной зависимости от температуры.
Так, например, известно, что реакция, приводящая к утяжелению углекислоты (росту отношения 18O/16О) при 250С определяется величиной К = 1,0407:
С16О2 + Н218О ↔ С18О2 + Н216О
Чем ниже температура, тем интенсивнее будет фракционирование, и наоборот, чем выше температура, тем меньше различие в изотопном составе продуктов реакции. При очень высоких температурах фракционирование настолько незначительно, что не фиксируется современными методами изотопного анализа.
В настоящее время допускается, что минерал, образовавшийся при некоторой температуре, является закрытой системой и не обменивает изотопы до того момента, пока не утратит свойственную ему кристаллическую структуру.
Это послужило основанием для палеотермометрии, основанной на том, что, полагая неизменным изотопный состав кислорода океана за последние 500 млн. лет, содержание d 18O в карбонатах скелетов различных моллюсков рассматривалось как функция температуры древнего моря, в котором происходил их рост. Таким образом, была рассчитана, например, температура мелового моря Русской платформы, которое имело среднюю годовую температуру, варьирующую от 14 до 18 0С. Были также проведены послойные определения температур по величине d 18О в рострах белемнитов, свидетельствовавших о том, что начало их жизни относилось к летним месяцам с температурами около 28°С, а в дальнейшем, по мере роста организма, белемниты переселялись на большие глубины, где годовые температуры колебались от 14 до 180С.
Г.Юри вычислил константы равновесия реакций изотопного обмена в зависимости от температуры для различных пар соединении. При этом было установлено, что распределение изотопов между минералами может происходить при температурах менее 1200 -13000С. Методы кислородной геотермометрии дают хорошие результаты, если установлена пара, в которой происходил изотопный обмен, что, к сожалению, известно далеко не всегда.
 На рисунке 5.5. показано распределение изотопов кислорода между различными земными объектами.
На рисунке 5.5. показано распределение изотопов кислорода между различными земными объектами.
Максимальны различия значений 18O между атмосферной влагой и осадочными породами. Это показывает, что фракционирование изотопов наиболее интенсивно идет в поверхностных условиях. С повышением температуры эффект изотопного обмена нивелируется.
Ультраосновные породы характеризуются изотопным составом кислорода близким к метеоритному. Граниты повторяют изотопно-кислородные соотношения метаморфических пород, которые в свою очередь наследуют эти характеристики материнских осадочных пород. Эти отношения подтверждают вывод В.И. Вернадского, отметившего задолго до появления изотопного анализа, что граниты несут следы «былых биосфер».
Сера имеет четыре изотопа (табл. 5.3.), из которых наиболее распространены два – 34S и 32S.
| Таблица 5.3.Распространенность изотопов серы | |
| 32S | 95,1 |
| 33S | 0,47 |
| 34S | 4,2 |
| 35S | 0,02 |
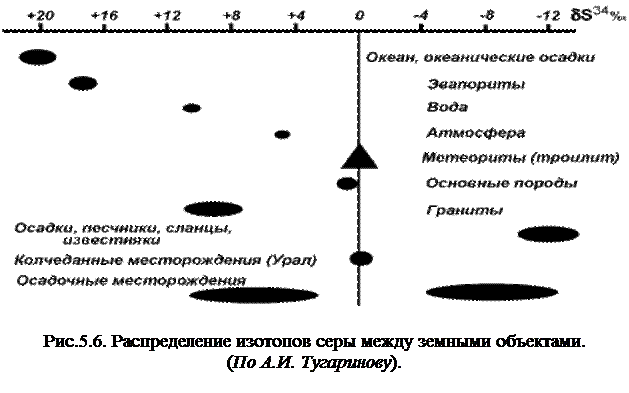 Сдвиги отношений между ними могут быть выражены через S34, которое будет иметь знак «плюс» в случае возрастания отношения S34/S32 по сравнению с принимаемым началом координат и знак «минус» — при его убывании (рис. 5.6).
Сдвиги отношений между ними могут быть выражены через S34, которое будет иметь знак «плюс» в случае возрастания отношения S34/S32 по сравнению с принимаемым началом координат и знак «минус» — при его убывании (рис. 5.6).
За нулевой отсчет принимается соотношение изотопов в троилите метеорита Каньон Диаболо.
Близкие значения обнаруживаются в сере колчеданных месторождений Урала и породах основного состава. Исследование различных реакций окисления и восстановления серы позволило сделать вывод, что каждая из них может вызывать определенный изотопный обмен, выражающийся в изотопном сдвиге. При этом с повышением температуры этот эффект снижается и при 1000°С исчезает совсем.
Очень распространенные в природе процессы восстановления сульфата при воздействии на него органического вещества, привели к четкому разделению серы земной коры на две группы — серу биогенных сульфидов и газов, обогащенную изотопом S32, и серу сульфатов, содержащую максимальное количество S34.
Наибольшее отклонение в положительную сторону дают океанические осадки (+20 d S34%0), что связано с активной бактериальной восстановительной деятельностью. Осадочные песчаники, сланцы, известняки, не содержащие органических веществ, дают отклонение в противоположную сторону (-10 ÷ -14 d S34%0). Генеральная выборка по осадочным месторождениям дает два максимума в области положительных и отрицательных значений d S34%0.
Особый интерес геохимия изотопов серы вызывает при решении вопросов генезиса рудных месторождений. Наблюдающееся здесь раздвоение изотопных отношений серы объясняется тем, за счет какой серы (тяжелой или легкой) происходит образование сульфидных минералов в разных группах месторождений. Здесь необходим специальный анализ конкретных ситуаций с учетом истории геологического развития данной территории.
Космогенные радионуклиды составляют ничтожную долю в общей сумме радионуклидов Земли. Все они сравнительно короткоживущие и присутствуют в земном веществе лишь благодаря постоянно идущим ядерным реакциям, вызываемым космическим облучением нашей планеты. Большинство из них образуется в атмосфере, и затем обменивается с другими резервуарами.
В океанических осадках аккумулируется основная часть 10Be, 26 Al, 32Si. В водных резервуарах сосредотачивается львиная доля 3Н и 14С. Отсюда они поглощаются живым веществом, вступая в биогеохимический цикл до своего распада. С момента прекращения обмена с атмосферным резервуаром количество изотопа меняется строго в соответствии с константой распада.
Основные условия применения космогенных радионуклидов для определения временных характеристик геологических процессов следующие:
1. Интенсивность космического излучения и, как следствие, концентрация радионуклида оставались практически постоянной в течение интервала времени, охватываемого соответствующим методом.
2. Время обмена радионуклида между атмосферными земными резервуарами должно быть постоянно и значительно меньше его периода полураспада.
3. С момента выхода из равновесного обменного цикла изотопный состав образца изменялся только в результате радиоактивного распада, т. е. система была закрыта относительно исследуемого радионуклида.
При выборе радионуклида в качестве трассера необходимо учитывать, чтобы его период полураспада был соизмерим с временной шкалой обмена исследуемого процесса. Например, среднее время кругооборота глубинных зон океанической воды порядка 1000 лет. Следовательно, для изучения циркуляции воды в океане мы должны использовать 14С (Т1/2 = 5730 лет). Но мы не можем использовать 36Сl (300 000 лет), так как он слишком долгоживущий, и 3Н, так как он слишком короткоживущий по сравнению с процессами циркуляции.
Необходимо также учитывать химические соединения, в составе которых поступает космогенный радионуклид. Например, 3Н, 36Сl, 14С находятся в морской воде в растворенном состоянии (1Н3НО, 36Сl, 14СO2 и др.). Именно эти радионуклиды могут служить трассерами воды либо выпадающих из нее солей (карбонатов, хлоридов). 32Si, 10Be поступают с аэрозольными частицами и входят в состав взвеси, нерастворимой в морской воде, поэтому они более удобны в качестве трассеров накопления глубоководных осадков.
Области применения космогенных радионуклидов достаточно разнообразны. Наибольшее распространение эти методы получили в геохимических, археологических и экологических исследованиях. В последнем направлении, после появления техногенных радиоизотопов, значительно расширился спектр радиогенных изотопов, маркирующих процессы их миграции, рассеяния и концентрации. В сферу изучения вошли 90Sr, 137Cs, 121I, 141Ce, 60Со и др.
Изотоп углерода 14С - чрезвычайно мало распространенный (период полураспада 5730 лет, равновесное количество на Земле 7,5.107 т), образуется в результате космического облучения преимущественно в верхних слоях атмосферы. Поглощение биосферой происходит в процессах фотосинтеза. Среднее содержание космогенного 14С в обменном углероде биосферы равно 1,07.10-10%, а удельная активность составляет 13-17 распадов в минуту на 1 г. углерода. После прекращения углеродного обмена поглощенное количество радиогенного углерода начинает уменьшаться. Примерно через 60 тыс. лет остается около 0,1% его первоначального количества. Это определяет верхний предел возможности радиоуглеродного датирования, который не превышает 60 тыс.лет. Практически предел возможного использования метода ограничивается пятикратным значением периода полураспада. Для углерода это 30 тыс. лет.
Радиоуглеродный метод широко применяется в геологии, гидрогеологии, океанологии, археологии для датирования событий позднечетвертичного времени.
Приведем отдельные примеры его использования.
1.Изучение изотопного состава донных илов Черного моря в согласии с геологическими и биологическими наблюдениями показало, что сероводородное заражение моря началось после того, как произошел прорыв морских вод из Босфора. В воде, богатой сульфатами, при отсутствии достаточного вертикального перемешивания развился процесс биогенной редукции сульфатов. Время возникновения сероводородного заражения оказалось около 7500—8000 лет назад, причем длительность процесса составляла около сотни лет.
2.Определение возраста подземных вод. В поверхностной зоне вода имеет постоянную равновесную с атмосферой концентрацию 14С, которая убывает по закону радиоактивного распада по мере удаления воды от земной поверхности.
3.Определение возраста почв проводят по 14С почвенного гумуса. Так, возраст гумуса подзолистых почв на глубине 70—80 см составляет 2,5 тыс. лет. Формирование черноземов еще более длительно и для мощности 90—100 см составляет 5—5,5 тыс. лет.
4.Датирование морских террас. Так, последние трансгрессии Каспийского моря проходили в интервале времени: XXIV—XXII вв. до н.э., X—IX вв. до н.э.,IX—XI вв. н.э. При этом уровень моря повышался на 20—40 м.
Тритий. Тритиевый метод использует радиоактивный распад трития, непрерывно образующегося в верхних слоях атмосферы и попадающего на землю с атмосферными осадками в форме 1Н3НО. Период полураспада трития 12,3 года. Поэтому метод нашел применение при изучении и датировании молодых природных вод, связанных с атмосферными осадками, возраст которых не превышает 60—70 лет.
Источником трития является лишь атмосферная вода. Попадая в воды зоны затрудненного водообмена, тритий постепенно распадается и через 60—70 лет практически исчезает. Присутствие в подземных водах трития однозначно говорит об их связи с атмосферными водами. Считают, что лишь 3—5% вторичных нейтронов, возникающих в атмосфере под действием космического излучения, участвует в образовании трития. Скорость образования космогенного трития примерно 30 атомов/(см2 • мин). Доля природного трития в атмосферой воде крайне низка. Поэтому концентрацию трития принято выражать в специальных «тритиевых» единицах — ТЕ (за 1ТЕ принято его содержание, при котором 3Н/1Н=10-18).
До начала ядерных испытаний концентрация трития варьировала в пределах 0,1–10ТЕ, а общий запас на Земле составлял 1,3 • 1018 Бк[14]. Основная часть этого количества: ~ 93% -- находится в гидросфере и лишь 7% — в атмосфере.
Ядерные взрывы в атмосфере переместили большое количество трития в стратосферный резервуар, где его запас достиг 200 кг (общий запас космогенного трития равен 1,8 кг). Концентрация 3Н в атмосферных осадках в этот период достигала 10000 ТЕ в отдельных пунктах Земли. В настоящее время значительная часть бомбового трития распалась.
Тритиевый метод нашел применение при изучении различных типов современных вод (океанических, континентальных, подземных), а также для обнаружения связи древних вод с атмосферными.
Date: 2015-09-25; view: 1423; Нарушение авторских прав