
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Природные воды
|
|
К природным водам относятся воды: Мирового океана, подземных вод, ледника, озер, почвенной влаги, паров атмосферы, речных вод (табл. 3.12.). В Мировом океане глубины от 3 до 6 км; средняя глубина океанов – 3,8 км. Особая роль воды земной коры связана с двумя основными моментами.

Во-первых, она занимает 70,8% (361 млн. км 2) поверхности Земли (см. рис 3.2), и, проникая в атмосферу и литосферу, способствует активному обмену веществом между этими геосферами.
Во-вторых, она обладает своеобразными физико-химическими свойствами, отличающими ее от большинства других природных образований. Наибольшую плотность вода имеет при +40С (1,00 г/см3). При плавлении льда в тройной точке (точка 1 на рисунке 6.1), при темпе 00С и давлении 1 атм. плотность воды увеличивается с 0,9168 до 0,9999 г/см3. Это приводит к тому, что водные бассейны замерзают с поверхности (лед легче воды). Превращаясь в пар (газ), при атмосферном давлении, вода увеличивается в объеме в 1700 раз. Жидкая вода всегда подвижна.
Криосфера (это вся замерзшая вода: лед, снег) - это часть гидросферы. Она характеризуется отрицательной температурой почв и горных пород и наличием подземных льдов. В зоне мерзлых пород находится около четверти всей суши земного шара и 60% территории России. На севере мерзлые породы лежат сплошным пластом, южнее - в виде островов. Нижней границей криолитозоны является поверхность с температурой 0° С. Глубина ее залегания от нескольких метров в умеренных широтах до нескольких километров в высоких. По времени существования выделяют области многолетнего и сезонного промерзания пород. Летом слой почвы оттаивает не более чем на 2 м, а глубже залегают ледяной грунт, промерзшие породы.
Понятие газовая и надкритическая фаза не одно и тоже, хотя в некоторых геологических работах их применяют как синонимы. В критической точке (точка 2 на рис. 6.1) линия фазового раздела исчезает. Переход из одной фазы в другую может происходить постепенно, без фазовых скачков. На рисунке 6.1 эти два разные пути от точки А (жидкая фаза) к точке В (газ) показаны штрихпунктирной линией. Можно понижая давление провести испарение всей жидкости (направление справа налево). В этом случае сначала в жидкой фазе на границе фазового перехода возникнет газовый пузырек, затем объем пузырька будет расти, а объем жидкой фазы постепенно уменьшаться, но до полного ее исчезновения будет существовать граница между фазами.
Растворенные в воде вещества изменяют структуру воды и ее свойства, заполняя межатомные пространства. Так электропроводность растворов во многие тысячи раз больше, чем чистой воды благодаря появлению свободных ионов. Снижается температура ее замерзания. Морская вода замерзает при температуре -1,90С. А близкий к насыщению раствор CaCl2 – при -360С.
Все природные воды земли в той или иной степени минерализованы. Поэтому свойства природных вод в той или иной степени отличаются от свойств чистой воды, но любое их поведение связано со свойствами самого растворителя.
Распределение запасов воды гидросферы по отдельным ее частям приведено в таблице 3.12., из которой видно, что 94% всех вод гидросферы сосредоточено в мировом океане. На втором и третьем месте подземные воды и ледники.
| Таблица 3.12. Объем воды гидросферы По Р.К. Клиге 1998 | ||
| Объем воды, тыс.км.3 | От общего объема, % | |
| Мировой океан | 94,32 | |
| Подземные воды | 3,83 | |
| Ледники | 1,92 | |
| Озера | 0,02 | |
| Почвенная влага | > 0.01 | |
| Пары атмосферы | > 0.01 | |
| Речные воды | > 0.01 | |
| Итого: |
Общая площадь океанов и морей в 2,5 раза превышает территорию суши. Океан является огромным мобильным резервуаром, регулирующим миграционные потоки элементов. Огромная масса воды, ее постоянное естественное перемешивание, достаточно быстрая кинетика создают благоприятные условия для поглощения и возвращения элементов и в атмосферу, и в литосферу. Наличие живого вещества существенно ускоряет целый ряд обменных процессов. Каждый литр океанической воды содержит всего 28 мг углерода. Но на всю массу океанической воды это составит 4.1014т. Это на два математических порядка (в 100 раз) больше, чем во всей атмосфере.
Однако это не только соотношение масс. Через океан и его живое вещество углерод уходит из атмосферы в осадочные породы литосферы. Объем пресных вод, пригодных для питья, составляет около 35 млн. км3. или 2,5% общих запасов воды на Земле (табл.6.2). Большая часть пресных вод (68,7 %) сосредоточена в ледниках и снежном покрове (основные запасы сосредоточены в Антарктиде). Распределение водных ресурсов на суше весьма неравномерное (табл. 3.16.).
Таблица 3.16. Запасы пресной воды на Земле (по Протасову, 2001)
| Местоположение | Объем (км3.106) | % к объему |
| Полярные и горные ледники | ||
| Грунтовые воды на глубинах, м: до 750 750 - 4000 | 4,2 5,3 | 13,6 |
| Озера | 0,12 | 0,03 |
| Реки | 0,12 | 0,03 |
| Почвы | 0,24 | 0,06 |
| Атмосфера | 0,13 | 0,035 |
| Всего | 39,0 |
В России азиатская часть обеспечена водными ресурсами намного лучше, чем европейская. Самым крупным пресноводным бассейном мира является озеро Байкал.
Несмотря на то, что общее количество наземных вод незначительно по сравнению с массой гидросферы, они очень важны, поскольку принимают активное участие в процессах выветривания, эрозии, поддержания и развития живого вещества.
В составе природных вод выделяются: макро- и микрокомпоненты в виде ионов и недиссоциированных молекул, газы, органические вещества, микроорганизмы (живое вещество).
Матричный растворитель - вода диссоциирует на ионы Н+ и ОН- по уравнению:
Н2О ↔ Н+ + ОН-
Мерой диссоциации служит ионное произведение воды
КW = [Н+] . [ОН-],
где [Н+] и [ОН-] концентрации ионов в молях на 1000 г Н2О. при температуре 220С КW = 10-14. Следовательно при равенстве концентраций [Н+] и [ОН-], концентрация каждого из этих ионов составит величину 10-7моль/кг Н2О.
Логарифм концентрации водородных ионов, взятый со знаком минус обозначается как рН и является одной из фундаментальных физико-химических характеристик растворов. Кислые растворы имеют значения рН<7, щелочные рН>7. Нейтральный по кислотности раствор имеет рН=7.
С повышением температуры ионное произведение воды возрастает, достигая максимума при температуре около 2200С (при давлении насыщенного пара, рисунок 3.17.), а затем начинает уменьшаться. Соответственно перемещается и точка нейтральной кислотности.
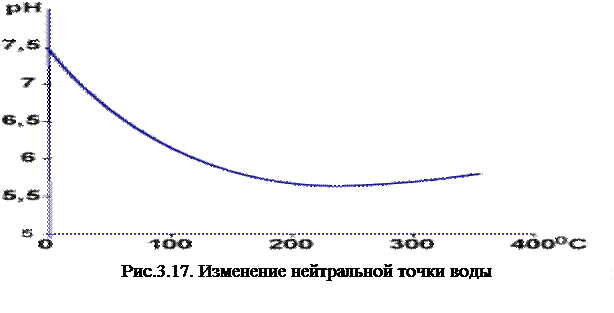
В соответствии с ГОСТом по величине минерализации воды делят на 4 группы:
1. пресные - до 1 г/кг H2O (<0.1%)
2. солоноватые - от 1 до 25 г/кг H2O (0.1-2.5%)
3. соляные - от 25 до 50 г/кг H2O (2.5-5.0%)
4. рассолы - выше 50 г/кг H2O (>5.0%)
Более высокие величины солености свидетельствуют либо о заражении вод продуктами деятельности человека, либо о дренировании аридных районов, где широко распространены засоленные воды.
Наиболее минерализованные (М до 760 г/л) являются хлоридные кальциевые рассолы, а наименее - ультрапресные гидрокарбонатные кальциевые и гидросиликатные кальциевые воды.
Макрокомпоненты растворов определяют химический тип воды, ее общую минерализацию (сухой остаток) и название по общему химическому составу. Они отображаются формулой Курлова,
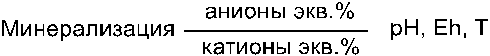
В начале формулы пишется общая минерализация раствора, затем идет дробь, в числителе которой записываются основные анионы (в порядке их убывания) и их концентрации в эквивалкентпроцентах, а в знаменателе точно также основные катионы. В конце записываются кислотность (рН), окислительно-восстановительный потенциал (Eh), температура и другие, наиболее важные характеристики.
Например:
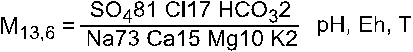
Особенности газового состава (концентрация радона, свободной углекислоты и т.д.) обычно фиксируются перед указанием минерализации.
Формула раствора обычно обозначается по основным катионам и анионам, концентрация которых выше 1экв.%. Название типа вод обычно записывают по двум-трем преобладающим анионам и катионам. В приведенном примере раствор будет сульфатно-хлоридный, натрово-кальциево-магниевый.
Состав растворенных в природных водах неорганических соединений определяется, прежде всего, составом литосферы и распространенностью отдельных составляющих ее элементов. Распространенность и содержание минеральных веществ в природных водах различны, в связи с чем среди них выделяются макро- и микрокомпоненты.
Органические вещества (Сорг, Nорг и Pорг) специфичны для определенных типов вод. Прежде всего, это почвенные и иловые воды, воды болот, торфяников, нефтяных и газовых залежей. Многие из органических соединений, являясь хорошими комплексообразователями, обеспечивают миграцию целого ряда тяжелых элементов, таких как Fe, Cu, Ni, Co, Cd и др.
В последнее время появляется все больше очагов повышенного заражения поверхностных вод органическими соединениями в связи с техногенным воздействием. Многие из них оказывают губительное воздействие на установившиеся природные равновесия, часто достаточно сложные. Так избыточное внесение хорошо растворимых соединений фосфора на сельскохозяйственные поля вызывают повышение его содержания в водоемах, что влечет за собой активное размножение водорослей, которые могут вывести из строя фильтры водозаборных систем.
Из микроорганизмов в природных водах наибольшее значение имеют бактерии, хотя обнаружены также микроскопические водоросли, простейшие и вирусы. Различают аэробные и анаэробные бактерии. Первые развиваются при наличии свободного кислорода в воде, а вторые при его отсутствии. В последнем случае анаэробы используют сульфаты, нитраты, углекислоту и другие кислородсодержащие вещества. Выделяют также факультативные аэробы, способные развиваться как в присутствии, так и в отсутствии свободного кислорода.
Общее число бактерий изменяется от нескольких тысяч до миллиона клеток в 1 мл воды, количество микроскопических водорослей и простейших достигает сотен и тысяч в 1 л воды. Число бактерий в воде зависит, главным образом, от наличия в ней питательных веществ, в том числе органических соединений. Чем выше содержание Сорг в водах, тем активнее развивается в них микрофлора. Содержащиеся в природных водах бактерии выполняют большую геохимическую работу, видоизменяя химический и газовый состав вод.
Газы и воды находятся в постоянном обмене. Основными газами природных вод являются: O2, N2, CO2, H2S, CnH(2n+2), H2, NH3, He, Ar, Kr, Xe, Rn.
По происхождению газы делятся на следующие основные группы:
1) воздушные (N2, O2, CO2, Ne, Ar), проникающие в литосферу из атмосферного воздуха;
2) биохимические (СH4, N2, H2S, CnH2n+2, H2), образующиеся при разложении микроорганизмами органических и минеральных веществ;
3) химические (CO2, CO, H2S, SO2, H2, NH3)
4) радиоактивные и продукты ядерных реакций (He, Rn).
Наиболее химически активными в природных водах являются кислород, углекислота, сероводород, водород. Содержание растворенного кислорода в природных водах обычно изменяется от < 1 до 20 мг/л. Он расходуется на различные окислительные процессы и поэтому с глубиной, т.е. по мере удаления от атмосферы и зон фотосинтеза, его содержание в природных водах уменьшается. Но, тем не менее, известно присутствие кислорода в подземных водах на глубинах до 1000 м и более.
Содержание растворенной в природных водах углекислоты изменяются в зависимости от мощности источника поступления и термобарических условий среды.
Пересыщенные растворы и метастабильные состояния. В некоторых природных растворах встречаются пресыщения отдельными компонентами. При оценке степени пресыщения природных вод по трудно растворимым соединениям используют отношение произведения активностей соответствующих свободных ионов в растворе к термодинамическому значению произведения растворимости (pL) соединения.
Например, для кальцита
r = (a Ca2+ + a CO32-)/pLCaCO3
Коэффициент пересыщения подземных вод по отдельным соединениям может достигать n .100. Степень пересыщения зависит от свойств данного вещества и особенностей химического состава подземных вод.
Чем больше энергия гидратации компонентов, тем труднее частицы объединяются в зародыши и тем большая вероятность образования ими пересыщенных растворов.
Обычно выделяют три основных химических типа рассолов:
1. Карбонатный, или содовый, тип. Главными компонентами являются СО32-, НСО3-, SO42-, Cl-, Na+, Ca+2 и Mg+2 в пределах растворимости их карбонатов.
2. Сульфатный тип. Главными компонентами являются SO42-, Cl-, Na+, Mg+2, СО32- (НСО3-), в пределах растворимости карбонатов Са и Мg. Ca+2 — в пределах растворимости карбоната и сульфата.
3. Хлоридный тип. Главными компонентами являются Cl-, Na+, Mg+2, Са. СО32- (НСО3-), в пределах растворимости карбонатов Са и Мg.
Химия океана. Хотя вода в современных океанах медленно перемешивается, в различных частях океана она различается по содержанию солей из-за:
1) разной концентрации солей и твердых веществ в водах, поступающих в океаны,
2) вертикального перепада температуры,
3) различия в скоростях испарения,
4) образования льда и его таяния,
5) различного количества осадков в различных районах океана,
6) постоянных океанских и морских течений.
Эти факторы обуславливают локальные различия и в составе донных осадков.
Традиционно, при рассмотрении состава морской воды употребляется термин соленость - общий вес растворенных веществ в 1 кг морской воды. Соленость обычно принято выражать в граммах на килограмм (г/кг) морской воды или в частях на тысячу (промилле ‰). В открытом океане соленость колеблется в среднем около 35‰ (что равно 35 г. соли на 1 кг воды), поднимаясь до 40‰ в Красном море и Персидском заливе, где выпаривание интенсивно, а приток и осаждение незначительны. Соленость Черного моря 22 ед., Каспийского моря – 13 ед.
Однако во всех пробах морской воды соотношения основных ионов практически постоянны, поэтому определение одного компонента обеспечивает получение данных по другим.
Точные сведения относительно среднего состава морской воды были впервые получены Диттмаром, который в 1884 г. проделал тщательный анализ 77 проб воды. Эти пробы были отобраны с различных глубин всех океанов во время кругосветного путешествия корабля "Челенджер" в 1872-1876 гг. В анализах Диттмара были определены галоиды, сульфат-ион, магний, кальций и калий, а в ряде образцов было установлено хлор-бромное отношение и карбонат-ион. Натрий был рассчитан по разности сумм эквивалентов отрицательных и положительных ионов ввиду отсутствия удовлетворительного прямого метода определения. Работа Диттмара показала, что в относительном составе морской воды нет значительных региональных колебаний. Современные данные по составу основных компонентов морской воды приведены в таблице 3.14.
Однако в морской воде обнаружено около семидесяти элементов. Очевидно, присутствуют и другие, которые не определены существующими аналитическими методами. Следует учитывать, что для некоторых элементов концентрации изменяются от места к месту вследствие биологической деятельности. Часто эти флуктуации связаны с глубиной, на которой отбирается проба, поскольку биологическая деятельность наиболее интенсивна в поверхностных и близповерхностных водах. Так, в поверхностных слоях содержание кальция, возможно, несколько понижено вследствие захвата его организмами для построения своих скелетов.
| Таблица 3.14. Основные растворенные вещества морской воды | ||
| Ион | Концентрация в ‰ | Проценты |
| Cl | 18,980 | 55,05 |
| Вг | 0,065 | 0,19 |
| S042- | 2,649 | 7,68 |
| НСО3- | 0,140 | 0,41 |
| F | 0,001 | 0,00 |
| Н3ВО3 | 0,026 | 0,07 |
| Mg | 1,272 | 3,69 |
| Са | 0,400 | 1,16 |
| Sr | 0,008 | 0,03 |
| К | 0,380 | 1,10 |
| Na | 10,556 | 30,61 |
| Сумма | 34,477 | 99,99 |
Поскольку атмосфера и гидросфера находятся в контакте, существует определенное соотношение между количеством газов в растворе и их парциальным давлением в атмосфере. Поверхностные воды находятся в равновесии или близки к равновесию с кислородом воздуха. С глубиной его содержания постепенно убывают.
Азот, растворенный в морской воде, не вступает в химические реакции и, следовательно, его концентрация остается постоянной. Кислород, с другой стороны, играет активную роль в обмене веществ и в распаде органического вещества, поэтому его содержание варьирует от места к месту.
Привнос и вынос элементов в океане. Сравнение показывает, что по химической природе морская вода существенно отличается от речной:
- в морской воде Na > Mg > Ca, Cl > SO4 > CO3,
- в речной воде Са > Na > Mg, CO3 > SO4 > Cl.
Более 90% хлоридов речных вод попадают в реки из океана через атмосферу.
Состав морской воды регулируется не только привносом растворенного материала при стоке вод суши, но, очевидно, и другими факторами. Среди них необходимо назвать подводные газовые и водяные струи (черные и белые курильщики) и подводные извержения лав. Вследствие адсорбции и ионного обмена с частицами осадков из раствора удаляются некоторые ионы. Другие вступают в реакцию с веществом осадков и образуют новые минералы, например глауконит.
Своеобразно распределение таких биогенных элементов как N, P, концентрация которых тесно связана с периодами развития морской биоты. Содержания фосфора в воде, активно поглощаемого живыми организмами, минимально в верхних слоях океана, в зонах развития живого вещества и постепенно растет с глубиной. Кроме того, наблюдается периодичность изменения концентрации биогенных элементов в верхних горизонтах. В периоды расцвета жизни концентрация их в воде уменьшается, но после отмирания организмов – растет.
Океан является огромным мобильным резервуаром, регулирующим миграционные потоки элементов. Огромная масса воды, ее постоянное естественное перемешивание, достаточно быстрая кинетика создают благоприятные условия для поглощения и возвращения элементов и в атмосферу, и в литосферу. Наличие живого вещества существенно ускоряет целый ряд обменных процессов. Каждый литр океанической воды содержит всего 28 мг углерода. Но на всю массу океанической воды это составит 4.1014 т. Это на два математических порядка (в 100 раз) больше, чем во всей атмосфере. Однако это не только соотношение масс. Через океан и его живое вещество углерод уходит из атмосферы в осадочные породы литосферы.
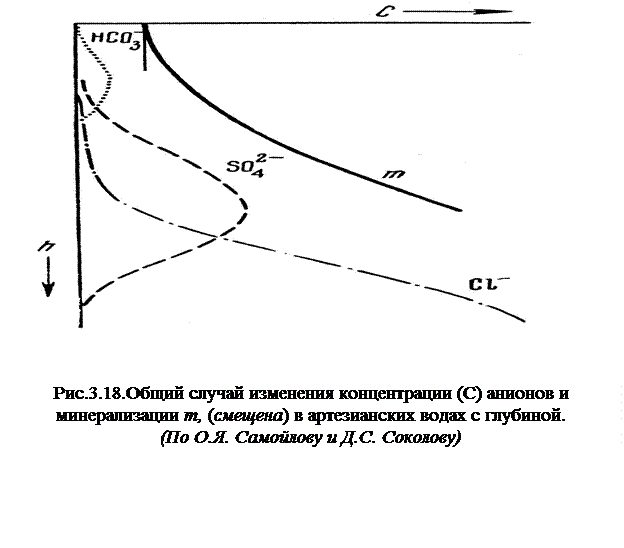 Подземные гидросферы. Гидрогеохимическая зональность. В 1900 г. С.Н. Никитин обратил внимание на рост минерализации с глубиной в Московском артезианском бассейне. Известны разные виды зональности: по площади и глубине, для грунтовых и напорных вод, для микрокомпонентов, микрофлоры и т.д. Наиболее общие закономерности характерны для вертикальной гидрохимической зональности анионной части подземных вод и общей минерализации в артезианских бассейнах.
Подземные гидросферы. Гидрогеохимическая зональность. В 1900 г. С.Н. Никитин обратил внимание на рост минерализации с глубиной в Московском артезианском бассейне. Известны разные виды зональности: по площади и глубине, для грунтовых и напорных вод, для микрокомпонентов, микрофлоры и т.д. Наиболее общие закономерности характерны для вертикальной гидрохимической зональности анионной части подземных вод и общей минерализации в артезианских бассейнах.
Верхние горизонты в большинстве случаев содержат пресные гидрокарбонатные воды, которые с глубиной переходят в гидрокабонат-сульфатные. Постепенно растет концентрация хлора, уменьшается содержание гидрокарбонатов и растворы становятся хлоридными. Одновременно с глубиной растет общая минерализация (Рис. 6.11). Общая тенденция такой зональности проявляется независимо от состава вмещающих пород.
Существуют различные объяснения механизмов ее формирования. К.В. Филатов связал ее с гравитационными явлениями, М.Г. Валяшко с захороненными хлоридными растворами, О.Я. Самойлов и Д.С. Соколов с гидратацией ионов и изменением теплового движения частиц. Однако эмпирически ясно одно: такая тенденция носит глобальный характер, и, независимо от проницаемости вмещающих пород, в геологическом масштабе времени между растворенными веществами может происходить химический обмен.
Возможно, направленная миграция анионов связана с общей тенденцией возрастания давления с глубиной и парциальными мольными объемами рассматриваемых ионов. Максимальный парциальный мольный объем`V° имеют гидрокарбонатные ионы (HCO3-) V°= 22,9 см3/г-ион, наименьший – хлор-ион 17,8 см3/г-ион. Естественно, что в таком барическом поле гидрокарбонатные ионы будут стремиться в область низких давлений, а хлор-ион – высоких.
Сложнее с ионами серы. В нейтральных растворах доминирует ион сульфата (SО42-,`V°=14,0). Однако в некоторых количествах могут присутствовать ионы гидросульфата (HSО4- 31,1 см3/г-ион), а в подземных водах, в отсутствии свободного кислорода, и более восстановленные формы этого элемента – НSО3- даже НS-, которые быстро окисляются при отборе проб и идентифицируются в обычном гидрохимическом анализе как ионы сульфата. Между всеми этими ионами существуют подвижные равновесия. Их парциальные мольные объемы колеблются от +31.1 до -7,9 см3/г-ион (S2-). В результате средний мольный объем может оказаться между гидрокарбонатными и хлоридными ионами.
Эти данные показывают, что К.В. Филатов был в принципе прав, говоря о тенденции распределении ионов в соответствии с «ионной плотностью». Так или иначе, но сам эмпирический факт наличия вертикальной гидрохимической зональности говорит о многомерной организованности биосферы и наличии сложных механизмов миграции элементов и взаимосвязи между отдельными ее частями.
Date: 2015-09-25; view: 2182; Нарушение авторских прав