
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Факторы, влияющие на электропроводность растворов
|
|
1. Природа ионов, природа растворителя
Подвижность тем больше, чем выше заряд и чем меньше размер иона, и чем меньше вязкость среды.
Ионы гидроксония (Н3О+)и гидроксила (ОН-) в водных растворах обладают аномально большой подвижностью за счет эстафетного механизма переноса протонов:
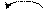
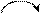 Н+ Н+
Н+ Н+
Н3О+ + Н2О = Н2О + Н3О+ ОН- + Н2О = Н2О + ОН-.
2. Температура.
А) При повышении температуры вязкость раствора уменьшается, а подвижность ионов увеличивается.
 Б) Температура влияет на степень диссоциации. С увеличением температуры увеличивается степень диссоциации, что ведет к возрастанию концентрации ионов, но эта зависимость не однозначна.
Б) Температура влияет на степень диссоциации. С увеличением температуры увеличивается степень диссоциации, что ведет к возрастанию концентрации ионов, но эта зависимость не однозначна.
3. Концентрация.
В сильноразбавленных растворах концентрация ионов мала, и их движению ничего не препятствует. Для предельно разбавленных растворов Кольрауш сформулировал следующий закон (закон независимого движения Кольрауша): в бесконечно разбавленном растворе ионы движутся независимо друг от друга:
l0 = lк0 + lа0,
где lк0 и lа0 – молярные подвижности ионов при предельном разбавлении (предельные подвижности).
Это уравнение справедливо и для сильных и для слабых электролитов.
Казалось бы, молярная электропроводность рассчитывается уже с учетом концентрации и не должна от нее зависеть. Но с ростом концентрации электролита молярная электропроводность будет зависеть и от степени диссоциации (a, в основном для слабых электролитов) и от электрического взаимодействия между ионами (в основном для сильных электролитов).
Для чистого раствора слабого электролита:
l = a× l0.
Это соотношение называется уравнением Аррениуса. Подставляя его в закон разведения Оствальда Кд = α2с / (1- α), получим:
Кд = λс ·С/ λ0 (λ0 – λс).
Для раствора же сильного электролита аналогичное соотношение приобретает вид: l = fl×l¥,
где fl - коэффициент электрической проводимости, учитывающий межионные взаимодействия.
Графический вид зависимости молярной электропроводности l от концентрации представлен на рисунке.
Эта зависимость может быть объяснена только с позиций теории электрической проводимости сильных электролитов Дебая и Онзагера, которая основана на электростатической теории сильных электролитов Дебая и Хюккеля, и объясняет уменьшение молярной электропроводности при переходе от бесконечно разбавленного раствора к растворам конечных концентраций появлением эффектов торможения движения ионов.
1. Релаксационный эффект торможения связан с существованием ионной атмосферы. При перемещении под действием внешнего электрического поля центральный ион выходит из центра ионной атмосферы, которая вновь воссоздается в новом положении иона. Этот процесс происходит не мгновенно, а в течение некоторого времени (времени релаксации). Поэтому заряд ионной атмосферы позади центрального иона больше, чем впереди. Возникающие при этом силы электростатического притяжения тормозят движение иона.
2. Электрофоретический эффект торможения. Этот эффект торможения возникает за счет того, что сольватированная ионная атмосфера, обладая зарядом, противоположным по знаку заряду центрального иона, движется в противоположном направлении. Таким образом, сольватированный центральный ион под действием электрического напряжения перемещается не в неподвижной среде, а в среде, перемещающейся ему навстречу, что приводит к снижению его скорости движения.
Зависимость удельной электрической проводимости растворов от концентрации.
Графическая зависимость удельной электропроводности от концентрации имеет вид, изображенный на рис.

Начальный рост удельной электропроводности обусловлен увеличением концентрации ионов (числа носителей заряда), а дальнейший спад связан с увеличением сил межионного взаимодействия в растворах сильных электролитов и уменьшением степени диссоциации в растворах слабых электролитов. Согласно формуле: æ = Сa(l0К + l0А)×103.
Электропроводность растворов находят кондуктометрическим методом, определяя сопротивление Rяч в специальной двухэлектродной ячейке с платиновыми электродами, включенной в мостовую схему переменнотоковых измерений (схему моста Уитстона). Удельную электропроводность находят по формуле:
æ = Кяч / Rяч, [Ом-1м-1] (4)
где Кяч – постоянная данной ячейки.
Организм с точки зрения электрохимии можно рассматривать как систему, состоящую из клеток и межклеточного пространства, заполненного раствором электролитов. Биологические ткани и жидкости являются проводниками второго рода, в которых электричество переносится ионами электролитов. Удельная электропроводность клеток составляет приблизительно 10-3–10-9Ом-1м-1, амежклеточной жидкости – 10-3Ом-1м-1.По электропроводности биологические ткани можно располагаются: кровь, лимфа, желчь > мышечная ткань, серое вещество мозга > ткани легких, печени, сердца > жировая ткань, костная ткань > слой эпидермиса кожи.
Date: 2015-09-24; view: 2018; Нарушение авторских прав