
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Классификация цепей
|
|
В химических цепях источником электрической энергии является энергия Гиббса протекающей в системе окислительно-восстановительной («токообразующей») химической реакции. Реакции окисления и восстановления («полуреакции») в гальваническом элементе протекают на разных электродах, т.е. пространственно разделены. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, - катод. Электроны, образующиеся в процессе окисления на аноде, перемещаются по внешней цепи к катоду, на котором они участвуют в процессе восстановления. Комбинируя различные окислительно-восстановительные полуреакции, можно получить большое число гальванических элементов.
Концентрационные цепи состоят из одинаковых электродов, но отличаются концентрацией веществ, участвующих в окислительно-восстановительных процессах. Концентрационные цепи можно составить из электродов первого и второго рода с разной концентрацией растворов или из газовых электродов с разными давлениями газов.
Электрохимическая цепь называется правильно разомкнутой, если на ее концах находятся одинаковые металлы. На практике это обычно достигается подключением к обоим концам электрохимической цепи проводников из одного и того же металла (например, медных). Разность потенциалов на концах правильно разомкнутой цепи называется электродвижущей силой (ЭДС).
Если гальванический элемент работает обратимо при постоянных температуре и давлении, то его ЭДС однозначно связана с ∆G протекающей в нем химической реакции. В этих условиях уменьшение энергии Гиббса равно полезной работе, которую может совершить гальванический элемент:
∆G = - zF∆E, (1)
где z – число электронов, участвующих в реакции, F – постоянная Фарадея, ∆Е – ЭДС элемента.
Электрохимические цепи являются равновесными только в том случае, если они не содержат границы раздела между разными растворами (т.е. являются цепями без переноса) и, кроме того, если ЭДС цепи скомпенсирована разностью потенциалов от внешнего источника электрического тока. Цепи с переносом не являются полностью равновесными, поскольку на границе раздела двух растворов происходит диффузия катионов и анионов. В результате на границе раздела возникает диффузионный потенциал – дополнительная разность потенциалов, обусловленная разной скоростью переноса катионов и анионов через границу. Диффузионный потенциал вносит неопределенный вклад в ЭДС цепи, точно рассчитать его невозможно, поскольку неизвестны активности отдельных ионов. Для уменьшения диффузионного потенциала между растворами помещают солевой мостик – концентрированный раствор нейтральной соли, подвижность катиона и аниона которой приблизительно одинаковы (КСl, KNO3, NH4NO3). В результате одна граница между двумя растворами заменяется двумя границами: раствор 1 – солевой мостик и солевой мостик – раствор 2. Диффузионные потенциалы на этих границах близки по величине и противоположны по знаку, поэтому их суммарный вклад в ЭДС резко уменьшается, и им можно пренебречь по сравнению с ошибкой эксперимента.
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля-Якоби):
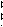 Zn│ZnSO4 CuSO4│Cu или Zn│ZnSO4 ║ CuSO4│Cu
Zn│ZnSO4 CuSO4│Cu или Zn│ZnSO4 ║ CuSO4│Cu
 где сплошная вертикальная линия│обозначает границу раздела между разными фазами, пунктирная вертикальная линия – границу между разными растворами, а двойная сплошная вертикальная линия ║ - солевой мостик. Гальванический элемент принято записывать так, чтобы анод находился слева.
где сплошная вертикальная линия│обозначает границу раздела между разными фазами, пунктирная вертикальная линия – границу между разными растворами, а двойная сплошная вертикальная линия ║ - солевой мостик. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные реакции (как окислительные, так и восстановительные) обычно записывают как реакции восстановления, поэтому общая реакция в гальваническом элементе записывается как разность между реакциями, протекающими на правом и левом электродах:
Правый электрод: Cu2+ + 2e = Cu.
Левый электрод: Zn2+ + 2e = Zn.
Общая реакция: Сu2+ + Zn = Cu + Zn2+.
ЭДС элемента равна разности потенциалов правого (катода) и левого (анода) электродов:
∆Е = Еп – Ел или же ∆Е = ЕК – ЕА (2)
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно, поскольку, согласно уравнению (1), для этой реакции ∆G < 0. Если ЭДС элемента отрицательна, то самопроизвольно протекает обратная реакция.
Date: 2015-09-24; view: 836; Нарушение авторских прав