
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Сопоставление энергии химической связи с длинами волн l эффективного излучения
|
|
| Химическая связь | Энергия связи, ккал/моль | Эффективное излучение, нм | Химическая связь | Энергия связи, ккал/моль | Эффективное излучение, нм |
| H-OH | l£241 | C-C | l£335 | ||
| H-Cl | l£280 | C=C | l£200 | ||
| H-Br | 87,6 | l£325 | CºC | l£144 | |
| H-I | 71,3 | l£400 | O-O | l£243 | |
| Br-Cl | 52,2 | l£545 | CH3-OH | l£317 | |
| I-Br | 42,5 | l£670 | CH3-CH3 | l£343 | |
| No-Cl | l£790 | CH3-I | l£528 |
Как видно из таблиц 6 и 7, энергия химической связи, как правило, меньше ионизации молекул (например, энергия ионизации N2 равно 359 ккал/моль, а для разрыва молекулы N2 на атомы требуется 225 ккал/моль; соответственно для молекулы О2 имеем 280,6 и 117 ккал/моль), для разрыва химической связи в большинстве случаев достаточно энергии квантов ближней УФ-области, а в некоторых случаях (для особо неустойчивых молекул) и видимой области спектра.
Если же энергия поглощения кванта недостаточна для ионизации или диссоциации, молекула переходит в электронно-возбужденное состояние, которое может быть или синглетным или триплетным.
Американским ученым Каша было показано, что при поглощении кванта света органические молекулы обычно переходят из основного состояния в самое низшее синглетное возбужденное состояние. Существует также определенная вероятность заселения и низшего триплетного возбужденного состояния.
Длительность пребывания молекулы в электронно-возбужденном синглетном состоянии – порядка 10-8-10-9 с, после чего молекула, если она за это время не встретится с партнером и химически не прореагирует, теряет энергию возбуждения. Потеря энергии может происходить разными путями. Один из них заключается в испускании излучении (флюоресценция) (рисунок 4). Явление флюоресценции свойственно как конденсированным системам (кристаллы, растворы), так и газам в разряженном состоянии. Так как реальные системы содержат очень большое количество молекул (1см3 газа при н.у. содержит 3·1019 молекул), обладающих различной энергией возбуждения, то при флюоресценции вещество излучает свет разных длин волн, т.е. имеет место спектр флюоресценции.
С увеличением концентрации газов и растворов, а также с увеличением температуры флюоресценция ослабевает (температурное и концентрационное тушение флюоресценции). Это объясняется тем, что с увеличением концентрации и температуры число столкновений молекул за единицу времени возрастает и, следовательно, возрастает вероятность того, что возбужденная молекула, еще не потерявшая энергию возбуждения путем флюоресценции, израсходует эту энергию либо на химическую реакцию, либо каким-то путем передаст энергию возбуждения другой, невозбужденной молекуле (что может привести к увеличению кинетической или колебательной энергии этой молекулы и, следовательно, к нагреванию тела).
Однако возбужденная молекула может совершить безызлучательный переход из возбужденного синглетного состояния в возбужденное триплетное состояние.
В результате этого значительно увеличился срок жизни возбужденного состояния, оно становится метастабильным: время жизни молекулы в возбужденном триплетном состоянии обычно составляет 10-4- 10-6 с, но в некоторых случаях оно значительно больше (секунды, минуты и даже часы). У многих органических молекул вероятность конверсии из синглетного в триплетное состояние близка к единице, и следовательно, концентрация возбужденных молекул в триплетном состоянии может быть весьма значительной. Вследствие относительного большого времени жизни молекул в этом состоянии вероятность столкновения триплетных молекул с молекулами-партнерами (т.е. вероятность химических реакций) значительно больше, чем для молекул в синглетном состоянии. Кроме того, по академику Теренину А.Н. молекула в триплетном состоянии может обладать свойствами бирадикала (два неспаренных электрона), что делает ее весьма реакционноспособной.
2 синглет
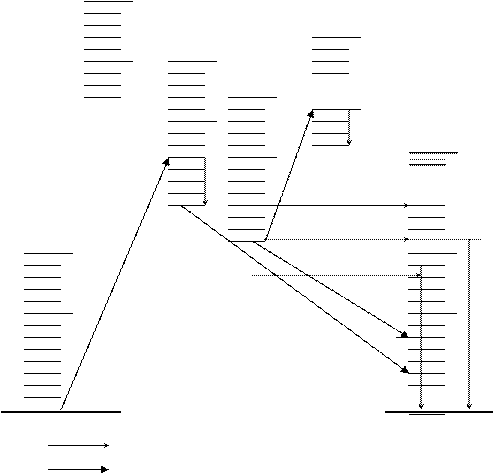 |
2 триплет
1 синглет
1 триплет
Т2 v*
Т2 v0
S1 v*
S1 v
T1 v0 S0 v*
Hν фосфоресценция
флюоресценция
S0 v0
S0 v0 Основное состояние
Переходы безылучательные
излучательные
Рисунок 6.1 Схема излучательных и безызлучательных
энергетических переходов молекулы
Этим определяется тот факт, что большее число фотохимических реакций органических соединений протекает через триплетное состояние молекул.
Молекулы, находящиеся в возбужденном триплетном состоянии, в тех случаях, когда взаимодействие их с молекулами-партнерами почему-либо затруднено (или молекулы-партнеры отсутствуют), могут терять энергию возбуждения путем излучения. Свечение молекулы, находящейся в возбужденном триплетном состоянии, называется фосфоресценцией. Фосфоресценция отличается от флюоресценции тем, что продолжается длительное время (от 10–4 с до нескольких часов) после выключения возбуждающего излучения.
Основная литература (1 осн. [32-37])
Дополнительная литература (5 доп. [113-120])
Контрольные вопросы:
1. Первичные фотофизические превращения в молекулах.
2. Условия диссоциации молекулы на атомы или радикалы
3. Явление люминесценции.
4. Определение флюоресценции, ее длительность
5. Понятие беызлучательного перехода возбужденной молекулы
6. Явление фоторесценции, ее длительность.
7. Понятие энергии разрыва химической связи
8. Виды потери энергии возбужденной молекулы
Date: 2015-09-24; view: 498; Нарушение авторских прав