
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Методы генной инженерии
|
|
Для получения рекомбинантной плазмиды ДНК одна из плазмид расщепляется выбранной рестриктазой. Гены, которые нужно ввести в бактериальную клетку, выщепляют из ДНК хромосом человека с помощью той же рестриктазы, поэтому его «липкие концы» являются комплементарными нуклеотидным последовательностям на концах плазми- ды. Ферментом лигазой «сшивают» оба конца ДНК (гена и плазмиды), в результате получается рекомбинантная кольцевая плазмида, которую вводят в бактерию E. coli. Все потомки этой бактерии называются клоном и содержат в плазмидах чужеродный ген, способный вырабатывать белок, кодируемый этим геном. Весь процесс получения таких бактерий, называют клонированием. Он состоит из последовательных стадий (см. рис. 4.1):
1. Рестрикции - разрезания ДНК человека рестриктазой на множество различных фрагментов, но с одинаковыми «липкими» концами. Такие же концы получают при разрезании плазмидной ДНК той же ре- стриктазой.
2. Лигирования - включения фрагмента ДНК человека в плазмиды благодаря сшиванию «липких концов» ферментом лигазой.
3. Трансформации - введения рекомбинантных плазмид в бактериальные клетки, обработанные специальным образом - так, чтобы они на короткое время стали проницаемыми для макромолекул. Однако плазмиды проникают лишь в часть обработанных бактерий. Их разделяют, используя определенную питательную среду (например, раствор антибиотика). Каждая из трансформированных бактерий размножается и образует колонию из многих тысяч потомков - клон.
4. Скрининга - отбора среди клонов трансформированных бактерий тех, которые сохраняют плазмиды, несущие ген человека.
Не всегда удается точно вырезать нужный ген с помощью ре- стриктаз. Многие гены расщепляются этими ферментами на несколько частей или не содержат последовательностей, узнаваемых рестриктаза- ми. Поэтому в ряде случаев процесс клонирования начинают не с вырезания из хромосом случайных фрагментов ДНК, а с целенаправленного получения нужного гена. Для этого из клеток человека выделяют и- РНК, которая является транскрипционной копией этого гена, и с помощью фермента - обратной транскриптазы (ревертазы) - синтезируют комплементарную цепь ДНК, после чего и-РНК, служащая матрицей при синтезе ДНК, уничтожается РНК-азой - специальным ферментом, способным гидролизовать цепь РНК. Оставшаяся цепь ДНК служит матрицей для синтеза обратной транскриптазой (ДНК-полимераза) комплементарной второй цепи ДНК. Получаемая двойная спираль ДНК носит название к-ДНК (комплементарная ДНК), она соответствует гену, с которого была считана и-РНК. Такая к-ДНК встраивается в плазмиду, которая трансформирует бактерии, и получают клоны, содержащие только выбранные гены человека.
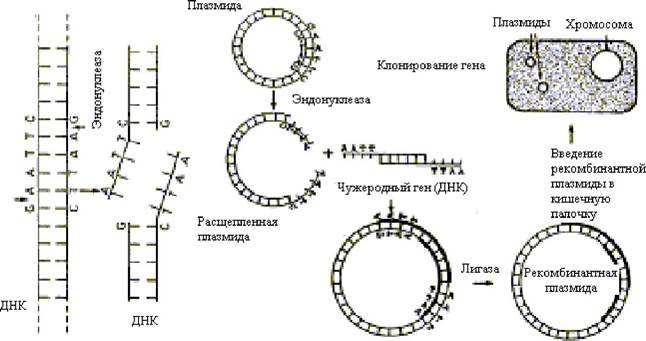 Рис. 4.1. Введение гена в плазмиду Escherichia coli и клонирование этого гена в клетках кишечной палочки
Плазмида E.coli расщепляется рестрикционной эндонуклеазой в специфическом участке в обеих цепях ДНК, так что на концах расщепленной плазмиды располагаются короткие неспаренные последовательности дезоксирибону- клеотидов (ТТАА или ААТТ), т. е. по четыре нуклеотида, в которых основания представлены тимином и аденином.
Ген, который нужно встроить в плазмиду, выщепляют с помощью этой же рестриктазы, так что его концы являются комплементарными нуклеотидным последовательностям на концах плазмиды (ААТТ и ТТАА).
Обе ДНК (гена и плазмиды) сшивают вместе с помощью лигазы. Затем рекомбинантную плазмиду вводят в клетку E.coli,которая, размножаясь, образует клон, все клетки которог содержат рекомбинантную плазмиду, а поэтому и чужеродный ген. Последний теперь клонирован в клетках кишечной палочки и индуцирует в ней синтез специфиче- скогобелка.
Рис. 4.1. Введение гена в плазмиду Escherichia coli и клонирование этого гена в клетках кишечной палочки
Плазмида E.coli расщепляется рестрикционной эндонуклеазой в специфическом участке в обеих цепях ДНК, так что на концах расщепленной плазмиды располагаются короткие неспаренные последовательности дезоксирибону- клеотидов (ТТАА или ААТТ), т. е. по четыре нуклеотида, в которых основания представлены тимином и аденином.
Ген, который нужно встроить в плазмиду, выщепляют с помощью этой же рестриктазы, так что его концы являются комплементарными нуклеотидным последовательностям на концах плазмиды (ААТТ и ТТАА).
Обе ДНК (гена и плазмиды) сшивают вместе с помощью лигазы. Затем рекомбинантную плазмиду вводят в клетку E.coli,которая, размножаясь, образует клон, все клетки которог содержат рекомбинантную плазмиду, а поэтому и чужеродный ген. Последний теперь клонирован в клетках кишечной палочки и индуцирует в ней синтез специфиче- скогобелка.
|
4.3. ПОЛУЧЕНИЕ ФАРМАКОЛОГИЧЕСКИХ ПРЕПАРАТОВ С ПОМОЩЬЮ МЕТОДОВ ГЕННОЙ ИНЖЕНЕРИИ
4.3.1. Биосинтез инсулина человека в клетках кишечной палочки
Инсулин - это белок, который является гормоном поджелудочной железы. Действие инсулина в основном направлено на обмен углеводов и проявляется снижением уровня сахара в крови (гипогликемический эффект). Это происходит за счет того, что инсулин облегчает переход глюкозы в клетки органов и тканей, где стимулирует ее активирование путем образования глюкозо-6-фосфата. Последний, окисляясь, обеспечивает клетки энергией. Таким образом, инсулин способствует периферическому окислению глюкозы. Наряду с этим инсулин тормозит распад гликогена в клетках печени. При этом снижаются процессы распада жиров и превращение аминокислот в глюкозу и происходит активирование синтеза жиров и белков. При недостатке инсулина развивается тяжелое заболевание - диабет; при этом разрушается нормальный обмен веществ. Диабетики должны получать инсулин ежедневно, если этого не происходит, то развивается тяжелое состояние - диабетическая кома, и организм погибает. Потребность в инсулине огромна. Долгое время источником инсулина служили железы коров и свиней. Учитывая, что поджелудочная железа коровы весит 200-250 г, для получения 100 г кристаллического инсулина нужно 800-1000 кг исходного сырья. Понятно, что животный инсулин не мог обеспечить всех больных. Например, в 1979 г. из 60-ти млн больных диабетом во всем мире, только 4 млн получали препарат инсулина.
Инсулин построен из двух полипептидных цепей А и В длиной 20 и 30 аминокислот, последовательность которых была установлена Сэн- гером в 1955 г. Синтез обеих цепей и соединение их дисульфидными связями для получения инсулина были проведены тремя коллективами исследователей в Сша, Китае и ФРГ в 1963 и 1965 гг. Однако осуществить в промышленном масштабе столь дорогостоящий и сложный синтез, который включает 170 химических реакций, оказалось трудно. Тем не менее в 1980 г. в Дании (компанией «Ново индастри») был разработан способ превращения инсулина свиньи в инсулин человека замещением остатка аланина, который является 30-й аминокислотой в цепи В на остаток треонина. Это удалось достигнуть путем ферментативного замещения с последующей хроматографической очисткой продукта; в результате был получен однокомпонентный инсулин человека 99 %-й чистоты. Исследования двух однокомпонентных инсулинов (человеческого и свиного) показали, что они не различались по активности и по времени действия. В 1982 г. инсулин производили главным образом две компании «Эли Лилли» (85 % сбыта инсулина в США и патент на его производство с 1923 г.) и «Ново индастри» (47,5 % сбыта гормона в Европе).
В организме животного две полипептидные цепи инсулина исходно являются частями одной белковой молекулы длиной 109 аминокислот - препроинсулина. При синтезе препроинсулина в клетках поджелудочной железы первые 23 аминокислоты служат сигналом для прохождения молекулы сквозь мембрану клетки; эти аминокислоты отщепляются, образуется проинсулин длиной 86 аминокислот. Молекула про- инсулина сворачивается таким образом, что начальный и конечный ее сегменты сближаются, а центральная часть молекулы удаляется с помощью ферментов. Так образуется инсулин. Роль центральной части сводится к правильному взаимному расположению двух цепей инсулина.
Гилберт с сотрудниками выделили и-РНК из поджелудочной железы крысы, синтезировали ДНК-копию (комплементарная ДНК), которая была встроена в плазмиду E. coli в среднюю часть гена пеницилли- назы (этот фермент в норме секретируется из клеток), и получили ре- комбинантную плазмиду. Как показало определение последовательности ДНК, рекомбинантная плазмида содержала информацию о структуре проинсулина, но не препроинсулина. При трансляции и-РНК в клетках кишечной палочки синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина. Далее отщепляли пенициллиназу и удаляли средний сегмент проинсулина действием трипсина. Позднее было показано, что полученные таким образом молекулы влияют на сахарный обмен, как гормон, выделенный из поджелудочной железы крысы.
В 1979 г. в США были синтезированы гены, кодирующие А и Б цепи инсулина. Далее каждый синтетический ген встраивали в плазми- ду E. coli в конце гена -галактозидазы. После этого синтезированные полипептиды отщепляли от фермента, проводили их очистку и цепи соединяли in vitro для получения полной молекулы инсулина.
В клетках E. coli был также осуществлен биосинтез проинсулина, а не только отдельных ее цепей. Для этого на и-РНК проинсулина синтезировали ее ДНК-копию с помощью обратной транскриптазы (ДНК- полимераза). Этот способ имеет серьезное преимущество, поскольку различные этапы экстракции и выделения гормона сведены к минимуму. С помощью этого метода был получен высокий выход гормона - 200 г на 1000 л культуральной жидкости (это эквивалентно количеству инсулина, выделенного из 1600 кг поджелудочной железы животных).
Исследователям из компании «Генентек» потребовалось 10 месяцев, чтобы в сентябре 1978 г. получить инсулин человека в специально сконструированном штамме кишечной палочки. Этот инсулин прошел самые серьезные и длительные испытания, которые показали, что он не вызывает никаких побочных явлений, как инсулин животных (у одного из каждых 20-ти больных инсулин животных вызывает аллергию; часто наблюдаются также расстройства почек и зрения). Кроме того, при длительном применении препарат не вызывал отрицательных иммунологических реакций.
Технология производства инсулина в бактериальных клетках имеет огромные преимущества перед получением инсулина из поджелудочной железы животных: не зависит от перебоев или количества сырья, конечный продукт всегда имеет одинаковый состав и степень чистоты.
В октябре 1982 г. был налажен выпуск «хемулина» (препарата синтетического инсулина человека) фирмой «Эли Лилли», которая затратила 100 млн долларов, чтобы начать поставку продукта на рынок.
4.3.2. Биосинтез соматотропина и других гормонов человека
Гормон роста человека, или соматотропин, синтезируется в головном мозге человека в передней доли гипофиза. Впервые он был выделен из трупного материала и очищен в 1963 г. При недостатке сома- тотропина развивается гипофизарная карликовость, частота встречаемости которой оценивается от 7 до 10 случаев на миллион человек. Гормон обладает видовой специфичностью, т. е. в отличие от инсулина гормоны роста животных не имеют активности в организме человека. Следовательно, единственным средством излечения гипофизарной карликовости является гормон гипофиза, который выделяли из трупов. Исследования показали, что при внутримышечном введении соматотропи- на в дозах 10 мг на 1 кг массы в течение года по три инъекции в неделю дает увеличение роста примерно на 8-18 см в год. Больные дети четы- рех-пяти лет при непрерывном лечении догоняли в росте своих сверстников к половой зрелости (14-16 лет).Если учесть тот факт, что из одного трупа можно получить 4-6 мг соматотропина, то можно понять, что лечение этого заболевания природным соматотропином - дело совершенно безнадежное. Помимо недостатка препарата возникли и другие проблемы, связанные с гетерогенностью гормона, выделяемого из трупного материала. Существовала также опасность, что гипофизарный материал заражен медленно развивающимися вирусами. Такие вирусы обладают необычайно длительным инкубационным периодом, поэтому дети, получавшие препарат, нуждались в многолетнем медицинском наблюдении.
Гормон роста человека, синтезированный в специально сконструированных клетках бактерий, имеет очевидные преимущества: он доступен в больших количествах, его препараты являются биохимически чистыми и свободны от вирусных загрязнений.
Биосинтез соматотропина (состоящего из 191-го аминокислотного остатка) специально сконструированными бактериями на основе кишечной палочки был осуществлен фирмой «Генентек». Поскольку при синтезе ДНК на и-РНК получается ген, кодирующий предшественник соматотропина, не расщепляющийся в бактериальных клетках с образованием активного гормона, то поступили следующим образом: на 1 этапе клонировали двунитевую ДНК-копию и-РНК и расщеплением ре- стрикционными эндонуклеазами получили последовательность, которая кодирует всю аминокислотную последовательность гормона, кроме 23-х первых аминокислот. Затем клонировали синтетический полинуклео- тид, соответствующий аминокислотам от 1-й до 23-й. Далее два фрагмента объединили вместе и «подстроили» в плазмиду E. coli, после чего клетки бактерии начали синтезировать этот гормон.
К 1980 г. были закончены клинические испытания препарата и тесты на токсичность и были начаты массовые эксперименты на детях, близких по возрасту к половой зрелости. Результаты были обнадеживающими, и синтетический соматотропин с 1982 г. начал производиться в промышленном масштабе.
Еще один гормон, b-эндорфин - опиат мозга, состоящий из 31-й аминокислоты, - был синтезирован в генетически сконструированных клетках кишечной палочки. В 1980 г. австралийский ученый Шайн и американские ученые Феттес, Лэн и Бакстер успешно клонировали ДНК, кодирующую b-эндорфин, в клетках E. сoli и получили этот полипептид в виде слитного белка с ферментом b-галактозидазой. На первом этапе они клонировали фрагмент ДНК, полученный в результате обратной транскрипции и-РНК, кодирующей b-эндорфин, и далее встраивали его в плазмиду E.coli за геном b-галактозидазы, при этом получили гибридный белок, состоящий из b-галактозидазы и b-эндорфина; далее ферментативно отщепляли b-галактозидазу, получая биологически активный b-эндорфин.
4.3.3. Получение интерферонов
Еще одним замечательным достижением генной инженерии является синтез интерферона.
Впервые интерферон был получен в 1957 г. в Национальном институте медицинских исследований вблизи Лондона. Это белок, который выделяется в очень низких количествах клетками животных и человека при попадании в организм вирусов и направлен на борьбу с ними. Первые же исследования выявили высокую биологическую активность интерферона при лечении гриппа, гепатита и даже раковых заболеваний (подавляет размножение аномальных клеток). Интерферон, как и соматотропин, обладает видовой специфичностью: интерфероны животных неактивны в организме человека и даже отторгаются им.
В организме человека вырабатывается несколько видов интерфе- ронов: лейкоцитарный (а), фибробластный (b) и иммунный (g) (Т- лимфоцитарный).
Природные интерфероны получают из крови человека с крайне низким выходом: в 1978 г. в Центральной лаборатории здравоохранения в Хельсинки (в то время мировой лидер в получении лейкоцитарного интерферона) из 50-ти тысяч литров крови было получено 0,1г чистого интерферона.
Процесс получения интерферонов в основных чертах был одинаков для всех типов клеток, выращиваемых в культурах и образующих интерферон. Клетки крови заражали вирусом Сендай и через 24 ч фильтровали на суперцентрифуге. В надосадочной жидкости содержался грубый препарат интерферона, который подвергали хроматографиче- ской очистке. Стоимость препарата была очень велика - 400 г интерферона стоил 2,2 млрд долларов. Однако перспективность фармакологического его использования (в том числе против четырех видов рака) заставляла искать новые пути его получения, в первую очередь с помощью генной инженерии.
В январе 1980 г. был получен интерферон человека в генетически сконструированных клетках кишечной палочки. Исходная трудность при этих методах заключалась в том, что и-РНК интерферонов мало даже в лейкоцитах, стимулированных заражением вирусов, и в том, что выходы были очень низкие: сообщалось о получении 1-2 молекул интерферона на одну бактериальную клетку. В 1981 г. фирме «Генентек» удалось сконструировать рекомбинантную ДНК, кодирующую g- интерферон, и ввести ее в геном бактерий, дрожжей и даже клетки млекопитающих, и они стали способными синтезировать интерферон с большим выходом - 1 л культуры клеток дрожжей содержал 1 млн единиц интерферона (единица интерферона соответствует такому его количеству, которое защищает 50 % клеток в культуре от заражения вирусом). Процесс был осуществлен следующим образом: исследователи выделили смесь молекул и-РНК из лимфоцитов человека, получили молекулы соответствующих ДНК-копий и ввели их в клетки E. coli. Далее были отобраны бактерии, продуцирующие интерферон.
4.3.4. Получение иммуногенных препаратов и вакцин
Другая область применения генной инженерии связана с получением новых эффективных, безопасных и дешевых вакцин.
Вакцины - одно из самых значительных достижений медицины, их использование к тому же чрезвычайно эффективно с экономической точки зрения. В последние годы разработке вакцин стали уделять особое внимание. Это обусловлено тем, что до настоящего времени не удалось получить высокоэффективные вакцины для предупреждения многих распространенных или опасных инфекционных заболеваний.
Повышенный интерес к вакцинам возник после того, как была установлена роль патогенных микроорганизмов в развитии тех заболеваний, которые ранее не считали инфекционными. Например, гастриты, язва желудка и двенадцатиперстной кишки, злокачественные новообразования печени (вирусы гепатита В и С).
Поэтому в последние 10-15 лет правительства многих стран стали принимать меры, направленные на интенсивную разработку и производство принципиально новых вакцин.
Используемые сегодня вакцины можно разделить в зависимости от методов их получения на следующие типы:
- живые аттенуированные вакцины;
- инактивированые вакцины;
- вакцины, содержащие очищенные компоненты микроорганизмов (протеины или полисахариды);
- рекомбинантные вакцины, содержащие компоненты микроорганизмов, полученные методом генной инженерии.
Технологию рекомбинантных ДНК применяют также для создания живых ослабленных вакцин нового типа, достигая аттенуации путем направленной мутации генов, кодирующих вирулентные протеины возбудителя заболевания. Эту же технологию используют и для получения живых рекомбинантных вакцин, встраивая гены, кодирующие им- муногенные протеины, в живые непатогенные вирусы или бактерии (векторы), которые и вводят человеку.
Принцип применения ДНК-вакцин заключается в том, что в организм пациента вводят молекулу ДНК, содержащую гены, кодирующие иммуногенные белки патогенного микроорганизма. ДНК-вакцины называют иначе генными или генетическими.
Для получения ДНК-вакцин ген, кодирующий продукцию имму- ногенного протеина какого-либо микроорганизма, встраивают в бактериальную плазмиду. Кроме гена, кодирующего вакцинирующий протеин, в плазмиду встраивают генетические элементы, которые необходимы для экспрессии («включения») этого гена в клетках эукариотов, в том числе человека, для обеспечения синтеза белка. Такую плазмиду вводят в культуру бактериальных клеток, чтобы получить большое количество копий. Затем плазмидную ДНК выделяют из бактерий, очищают от других молекул ДНК и примесей. Очищенная молекула ДНК и служит вакциной. Введение ДНК-вакцины обеспечивает синтез чужеродных протеинов клетками вакцинируемого организма, что приводит к последующей выработке иммунитета против соответствующего возбудителя. При этом плазмиды, содержащие соответствующий ген, не встраиваются в ДНК хромосом человека.
ДНК-вакцины обладают рядом преимуществ по сравнению с традиционными вакцинами:
- способствуют выработке антител к нативной молекуле вирусных протеинов;
- способствуют выработке цитотоксических Т-лимфоцитов;
- могут избирательно воздействовать на различные субпопуляции Т-лимфоцитов;
- способствуют формированию длительного иммунитета;
- устраняют риск инфицирования.
4.3.5. Другие области применения генной инженерии
Date: 2015-09-24; view: 1823; Нарушение авторских прав