
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гидроксиды
|
|
Оксиды
Оксидами называют соединения, состоящие из кислорода и какого-нибудь элемента El. Общую формулу оксидов можно записать как El x O y, где х и y – наименьшие целые числа, кратные валентности кислорода и элемента соответственно, например, 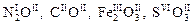 .
.
Названия оксидов дают по следующей схеме:
оксид _________________________________ (____________).
название элемента степень окисления элемента
Например: N2O – оксид азота (I), СО – оксид углерода (II), Fe2O3 – оксид железа (III), SO3 - оксид серы (VI).
По химическим свойствам оксиды делят на две группы: солеобразующие и несолеобразующие оксиды. Первой группе оксидов соответствуют соли, вторая группа оксидов солей не образует. В нее входят: СО, NO и др. Солеобразующие оксиды подразделяют на основные, амфотерные и кислотные оксиды.
Основные оксиды образованы металлами. Взаимодействуют с кислотами с образованием солей:
| Fe2O3 + 6 HCl ® 2 FeCl3 + 3H2O. | (1) |
Оксиды элементов I и II групп главных подгрупп периодической системы (за исключением бериллия и магния) взаимодействуют с водой с образованием соответствующих гидроксидов
| CaO + H2O ® Ca(OH)2 | (2) |
и с кислотными оксидами с образованием солей
| Na2O + CO2 ® Na2CO3. | (3) |
Амфотерные оксиды также образованы металлами. Обладают одновременно свойствами как основных, так и кислотных оксидов. Отличительным признаком амфотерных оксидов является способность взаимодействовать как с кислотами, так и со щелочами с образованием солей:
| ZnO + H2SO4 ® ZnSO4 + H2O, | (4) |
| ZnO + 2 KOH ® K2ZnO2 + H2O (при сплавлении), | (5) |
| ZnO + 2 KOH + H2O ® K2[Zn(OH)4] (в растворе). | (6) |
Наиболее распространенными представителями амфотерных оксидов являются ZnO, Al2O3, Cr2O3.
Кислотные оксиды в основном образованы неметаллами (SO3, CO2), но некоторые высшие оксиды металлов тоже являются кислотными (например, CrO3, Mn2O7 и др.). Главный отличительный признак кислотных оксидов – их способность взаимодействовать со щелочами с образованием солей:
| CO2 + 2 NaOH ® Na2CO3 + H2O, | (7) |
| CrO3 + 2 KOH ® K2CrO4 + H2O. | (8) |
Газообразные кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот
| SO2 + H2O ® H2SO3. | (9) |
Гидроксиды
Гидроксидами называют соединения, состоящие из положительного иона металла (иона аммония NH4+) и одной или нескольких гидроксогрупп (OH-). Общую формулу гидроксида можно записать как Me(OH) x, где х – степень окисления металла, например, NaOH, Fe(OH)2, Al(OH)3.
Названия гидроксидов дают по следующей схеме:
гидроксид _____________________________ (____________).
название металла степень окисления металла
Например: NaOH – гидроксид натрия, Fe(OH)2 – гидроксид железа (II), Al(OH)3 – гидроксид алюминия.
С точки зрения теории электролитической диссоциации основания и щелочи способны диссоциировать в растворе с образованием гидроксид-ионов (OH-). По химическим свойствам гидроксиды делят на щелочные, основные и амфотерные гидроксиды.
Щелочные гидроксиды (щелочи) образованы элементами I и II группы главной подгруппы периодической системы элементов, за исключением бериллия и магния. Все щелочи растворимы в воде, в отличие от остальных гидроксидов. Нерастворимые гидроксиды могут быть получены путем воздействия щелочей на соответствующие соли:
| CuSO4 + 2 NaOH ® Na2SO4 + Cu(OH)2¯. | (10) |
Все гидроксиды взаимодействуют с кислотами с образованием солей:
| Fe(OH)3 + 3 HNO3 ® Fe(NO3)3 + 3 H2O, | (11) |
| Zn(OH)2 + 2 HCl ® ZnCl2 + H2O. | (12) |
Амфотерными называют гидроксиды, которые могут взаимодействовать как с кислотами, так и со щелочами, образуя соли. К амфотерным гидроксидам, в частности, относятся Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3. Реакция амфотерного гидроксида со щелочью по-разному идет в растворе и в расплаве. В растворе идет образование гидроксокомплексов:
| Zn(OH)2 + 2 NaOH ® Na2[Zn(OH)4], | (13) |
а в расплаве происходит образование обычной соли:
| Zn(OH)2 + 2 NaOH ® Na2ZnO2 + Н2О. | (14) |
Date: 2015-09-24; view: 885; Нарушение авторских прав