
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения задач. Пример 1. Определить массовую долю алюминия в его оксиде и вычислить, сколько алюминия теоретически можно выделить из боксита массой 15 т с содержанием Al2O3
|
|
Пример 1. Определить массовую долю алюминия в его оксиде и вычислить, сколько алюминия теоретически можно выделить из боксита массой 15 т с содержанием Al2O3 87 %.
Решение. 1. Найдем молярную массу Al2O3:
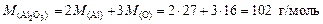 .
.
2. Примем количество вещества Al2O3 равным 1 моль, тогда количество вещества алюминия будет равно 2 моль. Масса оксида алюминия составит 102 г, а масса алюминия составит 2×27 = 54 г.
3. Вычислим массовую долю алюминия в его оксиде:
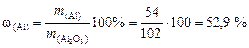 .
.
4. Вычислим массу чистого Al2O3 в боксите:
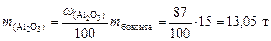 .
.
5. Масса алюминия, которую можно получить из боксита:
 .
.
Пример 2. При прокаливании 10 г некоторого вещества было получено 6,436 г CuO и 3,564 г CO2. Вывести формулу соединения.
Решение. 1. Найдем количество вещества оксида меди (II):
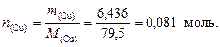
В 1 моль CuO содержится по 1 моль Cu и О, следовательно n (Cu) = n (O, CuO) = 0,081 моль.
2. Найдем количество вещества оксида углерода (IV):
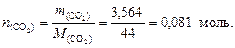
В 1 моль CO2 содержится 1 моль Cu и 2 моль О, следовательно n (C) = 0,081 моль,
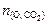 = 2×0,081 = 0,162 моль.
= 2×0,081 = 0,162 моль.
3. Общее количество вещества кислорода n (O) = 0,081 + 0,162 = 0,243 моль.
4. Сопоставим количества вещества элементов между собой:
n (Cu): n (C): n (O) = 0,081:0,081:0,243 = 1:1:(0,243/0,081) = 1:1:3.
Полученные целые числа представляют собой стехиометрические индексы формулы вещества, химическая формула которого: CuCO3.
Пример 3. Соединение серы с фтором содержит 62,8 % серы и 37,2 % фтора. Данное соединение при объеме 118 мл в газообразном состоянии (температура 7°С, давление 96,34 кПа) имеет массу 0,51 г. Какова истинная формула соединения?
Решение. 1. Рассчитаем истинную молярную массу соединения по уравнению Менделеева – Клапейрона (26): 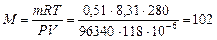 г/моль.
г/моль.
2. Обозначим x и y количество атомов серы и фтора в молекуле соответственно (S x F y). Зная процентное содержание каждого элемента в соединении и его молярную массу, получим 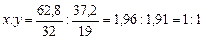
3. Таким образом, простейшая формула соединения – SF. Его молярная масса: М = 32+19=51 г/моль.
Соотношение молярных масс, истинной и простейшей:
 , следовательно, в искомой формуле содержится в 2 раза больше атомов каждого вида и ее формула S2F2.
, следовательно, в искомой формуле содержится в 2 раза больше атомов каждого вида и ее формула S2F2.
Пример 4. При окислении 2,81 г кадмия получено 3,21 г оксида кадмия. Вычислить эквивалентную массу кадмия и определить его валентность.
Решение. 1. По массе кадмия и массе его оксида найдем массу кислорода: m (O) = m (CdO) - m (Cd) = 3,21 - 2,81 = 0,4 г.
2. Образование оксида кадмия можно записать в виде схемы реакции Cd + O ® CdO, для которой составим пропорцию согласно закону эквивалентов (32):
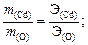
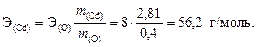
3. Сравнивая численные значения эквивалентной массы и молярной массы кадмия, находим:  , следовательно, валентность кадмия равна 2.
, следовательно, валентность кадмия равна 2.
Пример 5. Оксид марганца (IV) при прокаливании теряет кислород, образуя Mn3O4. Какой объем кислорода при температуре 27°С и давлении 1,1 атм. выделится из 0,58 кг MnO2?
Решение. Запишем уравнение реакции разложения:
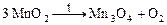 ,
,
из которого следует, что 3 моль MnO2 дают 1 моль кислорода.
Найдем количество вещества MnO2


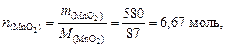
следовательно, образуется  .
.
2. Учитывая, что 1 атм. = 101325 Па, по уравнению Менделеева-Клапейрона (26) получим:
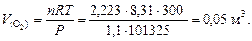
Пример 6. К раствору, содержащему 0,2 моль хлорного железа (FeCl3) прибавили 0,24 моль гидроксида натрия. Какое количество гидроксида железа при этом получилось?
Решение. 1. Составим уравнение реакции: FeCl3 + 3 NaOH ® Fe(OH)3 + 3 NaCl, из которого следует, что 1 моль FeCl3 взаимодействует с 3 моль NaOH, следовательно, для реакции с 0,2 моль хлорного железа требуется гидроксида натрия: 0,2×3 = 0,6 моль.
2. По условию задачи, количество вещества NaOH составляет 0,24 моль, т. е. он в недостатке. Дальнейший расчет ведем по гидроксиду натрия.
3. Составим пропорцию:
3 моль NaOH - 1 моль FeCl3
0,24 моль NaOH - х моль FeCl3,
из которой вычислим количество вещества гидроксида железа (III): 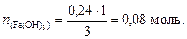
Date: 2015-09-24; view: 2259; Нарушение авторских прав