
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Определение процентной концентрации йода в анализируемом растворе
|
|
Задачи
1. Закрепить на практике знания, полученные на теоретических занятиях.
2. Закрепить навыки иодометрического титрования.
3. Освоить методику косвенного титрования.
Продолжительность занятия: 180 минут (4 академических часа).
Вопросы самоподготовки:
- Рабочие растворы метода иодометрии, исходные вещества метода иодометрии;
- Техника приготовления титрованных растворов;
- Условия йодометрического титрования.
Материальное обеспечение:
а) реактивы:
- K2Cr2O7 0,1 моль/л условных частиц 1/6 K2Cr2O7;
- Na2S2O3 0,1 моль/л условных частиц 1 Na2S2O3;
- Анализируемый раствор I2;
- HCl C(f HCl)= 2 моль/л
- крахмал.
б) посуда, оборудование:
- бюретки;
- пипетки;
- воронки;
- колбы для титрования.
в)Наглядные пособия:
- Периодическая система элементов Д.И. Менделеева;
- Таблица молекулярных масс.
Определение C(f Na2S2O3) по раствору K2Cr2O7
Na2S2O3 не является исходным веществом, поэтому его растворы готовят с титром установленным, а точная концентрация определяется путем титрования по раствору исходного вещества, т.е.по раствору K2Cr2O7.
K2Cr2O7 + 6KI + 14HCl ®2CrCl3 + 3I2 + 8KCl + 7H2O
Cr+6 +6ē®Cr+3 ½1 ½ – процесс восстановления f K2Cr2O7 =1/6
(окислитель)
2I- - 2ē ®I20 ½3 ½ – процесс окисления f KI=1
I2 + 2Na2S2O3 ® 2NaI + Na2S4O6

 2S2O3-2 - 2ē ® S4O6-2 ½1- процесс окисления f Na2S2O3=1
2S2O3-2 - 2ē ® S4O6-2 ½1- процесс окисления f Na2S2O3=1
(восстановитель)
I20 + 2ē ® 2I- ½ 1- процесс восстановления f I2=1/2
 (окислитель)
(окислитель)
Техника выполнения: Бюретку ополаскивают раствором Na2S2O3 и заполняют этим раствором по нижнему мениску. В склянку с притертой пробкой на 250 мл отмеривают пипеткой 10 мл стандартного раствораK2Cr2O7, прибавляют 5 мл 5 % раствора KI (мерным пальчиком), и 5 мл раствора HCl 2 моль/л (мерным пальчиком). Смеси дают постоять 5 минут в темном месте. Затем разбавляют смесь до 100 мл водой и титруют раствором Na2S2O3 до получения светло-желтой окраски раствора при постоянном интенсивном перемешивании. Затем добавляют 20 капель раствора крахмала. Раствор приобретает синюю окраску. Продолжают титровать раствором Na2S2O3 до обесцвечивания раствора (раствор может иметь слегка голубовато-зеленоватую окраску, которую придает Cr+3). Титрование повторяют 2-3 раза.
I-е титрование V1- …
II-е титрование V2 -…
III-е титрование V3 -…
V1·V2 ·V3
 V ср. = 3
V ср. = 3
C(f K2Cr2O7) ·V K2Cr2O7 = C(fNa2S2O3)· V Na2S2O3
C(f K2Cr2O7)· V K2Cr2O7
 C(f Na2S2O3) = V ср. Na2S2O3 = …….
C(f Na2S2O3) = V ср. Na2S2O3 = …….



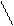
 C(f пр. Na2S2O3)
C(f пр. Na2S2O3)
К раствора Na2S2O3= C(f теор. Na2S2O3) = 0,1 = …….
C(f К2Cr2O7) смотри работу №21.
Date: 2015-09-24; view: 462; Нарушение авторских прав