
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Определение процентного содержания перекиси водорода в растворе
|
|
Дан 3 % раствор перекиси водорода.
Это раствор весо-объемной концентрации, т.е в 100 мл раствора содержится 3,0 грамма раствора Н2О2.
1. Расчет ориентировочного объема титранта. - сколько грамм Н2О2 содержится в 10 мл раствора

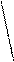 3 % Þ 100 мл раствора – 3,0 грамма Н2О2
3 % Þ 100 мл раствора – 3,0 грамма Н2О2
10 мл - 0,3 грамма Н2О2
- сколько мл раствора KMnO4 С(f KMnO4)=0,1 моль/л условных частиц 1/5 KMnO4 требуется на окисление 10 мл 3% раствора Н2О2.

 С(f KMnO4) ×M Н2О2 × f Н2О2 0,1 × 34,01 ×1/2
С(f KMnO4) ×M Н2О2 × f Н2О2 0,1 × 34,01 ×1/2
Т KMnO4 / Н2О2 = 1000 = 1000 = 0,0017 г/мл
1 мл раствора KMnO4 реагирует с 0,0017 грамма Н2О2
 х с 0,3
х с 0,3
100× 0,3
 х= 0,0017 = 176,47 мл раствора KMnO4 С(f KMnO4)=0,1 моль/л условных частиц 1/5 KMnO4.
х= 0,0017 = 176,47 мл раствора KMnO4 С(f KMnO4)=0,1 моль/л условных частиц 1/5 KMnO4.
эта цифра указывает на то, что непосредственно 3 % раствор Н2О2 оттитровать раствором KMnO4 нельзя Û надо готовить разведение.
Приготовление 100 мл раствора Н2О2 с С(f Н2О2)=0,1 моль/л условных частиц 1/2 Н2О2.
1. Сколько грамм химически чистой Н2О2 требуется для приготовления 100 мл раствора с С(f Н2О2)=0,1 моль/л условных частиц 1/2 Н2О2.
C(f Н2О2) ×f Н2О2 ×M Н2О2 ×Vколбы 0,1×1/2 ×34×100

 Q=T×V
Q=T×V  = 1000 = 1000 = 0,17 г.
= 1000 = 1000 = 0,17 г.
2. В каком объеме 3 % раствора содержится 0,17 грамм Н2О2.

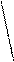 3 % Þ 100 мл раствора – 3,0 грамма Н2О2
3 % Þ 100 мл раствора – 3,0 грамма Н2О2
х - 0,17
100× 0,17
 х= 3 = 5,67 мл Н2О2.
х= 3 = 5,67 мл Н2О2.
Т.к. раствор Н2О2 нестабилен, то для приготовления разведения навеску Н2О2 берут с помощью пипетки Þ округляют до 10 мл.
2KMnO4 + 5Н2О2 + 3H2SO4 ®2MnSO4 + 5O2 + K2SO4 + 8H2O
Mn7+ +5ē®Mn2+ ½1 ½2 – процесс восстановления f KMnO4 =1/5
(окислитель)
О2-2 - 2ē ®О20 ½5 ½10 – процесс окисления f Н2О2=1/2
(восстановитель)
Техника определения: 10 мл анализируемого раствора отмеривают пипеткой, помещают в мерную колбу емкостью 100 мл и доводят объем раствора водой до метки, тщательно перемешивают. 10 мл, полученного раствора переносят пипеткой в колбу для титрования, прибавляют 5 мл 25% раствора H2SO4 (отмеривают мерным цилиндром). Бюретку заполняют титрованным растворомKMnO4, содержимое колбы титруют раствором KMnO4 до слабо розового окрашивания раствора. Титруют 2-3 раза.
I-е титрование V1- …
II-е титрование V2 -…
III-е титрование V3 -…
V1·V2 ·V3
 V ср. = 3
V ср. = 3
C(f KMnO4)× М. Н2О2 × f Н2О2 0,1×34,01× 1/2

 T KMnO4/Н2О2 = 1000 = 1000 = 0,0017 г/мл.
T KMnO4/Н2О2 = 1000 = 1000 = 0,0017 г/мл.
Vср. KMnO4× K KMnO4 × T KMnO4/ Н2О2 ×Vколбы×100
 % раствора Н2О2= Q×Vпип. = …
% раствора Н2О2= Q×Vпип. = …
K KMnO4 см. работа № 19
М.м. Н2О2= 34,01 г/моль
Вывод: в 100 мл препарата содержится … гр. химически чистой Н2О2.
Date: 2015-09-24; view: 1581; Нарушение авторских прав