
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Определение процентного содержания перекиси водорода в растворе. 1. Закрепление знаний и умений по теме «Метод перманганатометрии»
|
|
Задачи
1. Закрепление знаний и умений по теме «Метод перманганатометрии».
Продолжительность занятия: 180 минут (4 академических часа).
Вопросы самоподготовки:
- Основное уравнение метода, условия титрования;
- в каких случаях используют данный метод;
- уметь определять фактор эквивалентности окислителя и восстановителя в окислительно-восстановительной реакции;
- уметь фиксировать конец титрования в методе перманганатометрии;
- знать технику приготовления растворов.
Материальное обеспечение:
а) реактивы:
- раствор KMnO4 с С(f KMnO4)»0,1моль/л условных частиц 1/5 KMnO4;
- кристаллический FeSO4 ×7H2O;
- 25 % раствор H2SO4.
б) посуда, оборудован
- бюретки;
- пипетки;
- мерные колбы;
- воронки;
- колбы для титрования;
- ручные весы;
- аналитические весы.
в)Наглядные пособия:
- Периодическая система элементов Д.И. Менделеева.
- Таблица молярных масс.
- Таблица «Работа с мерной посудой».
Определение % содержания FeSO4 в препарате FeSO4 ×7H2O.
2KMnO4 + 8H2SO4 + 10FeSO4 ®2MnSO4 + 5 Fe2(SO4)3 + K2SO4 + 8H2O
Mn+7 +5 ē ®Mn+2 ½1 ½2 – окислитель f =1/5
Fe2+ - ē ®Fe3+ ½5 ½10 – восстановитель f =1
М.м FeSO4
|
М.м. FeSO4 ×7H2O =278 г/моль.
 |




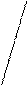

 Т FeSO4 ×7H2O =
Т FeSO4 ×7H2O =
Для определения % содержания FeSO4 в препарате FeSO4 ×7H2O необходимо приготовить 100 мл раствора с С (f FeSO4)=0,1 моль/л условных частиц FeSO4 1.
Расчет навески:
Q =T ×V=0,0278 г/мл × 100 мл =2,78 гр.

На ручных весочках отвешивают 2,78 грамм FeSO4 ×7H2O, пересыпают в бюкс и взвешивают на аналитических весах.
 масса бюкса с FeSO4 ×7H2O ...,…..
масса бюкса с FeSO4 ×7H2O ...,…..
масса пустого бюкса ..,…..
 Q практическая FeSO4 ×7H2O ..,…..
Q практическая FeSO4 ×7H2O ..,…..
Навеску из бюкса через сухую воронку переносят в мерную колбу на 100 мл, в которую предварительно помещают 15 мл 25 % раствора H2SO4 (отмеривают цилиндром).
Взятую навеску растворяют в H2SO4, хорошо перемешивая содержимое колбы, добавляют воду до метки, еще раз тщательно перемешивают.
Техника определения:
Бюретку ополаскивают, а затем заполняют титрованным раствором KMnO4. Пипетку ополаскивают раствором FeSO4 ×7H2O, затем отмеривают ею 10 мл анализируемого раствора и переносят в колбу для титрования. Прибавляют 10 мл 25 % раствора H2SO4 (отмеривают цилиндром) и титруют раствором KMnO4, прибавляя его по каплям при перемешивании, до появления розовой окраски.
Результаты титрования:
На титрование 10 мл раствора FeSO4 ×7H2O израсходовано 0,1 моль/л KMnO4.
1. титрование -V1 = V1+V2+ V3
2. 
 титрование - V2 = V ср KMnO4 =
титрование - V2 = V ср KMnO4 =
3.  титрование - V3 =
титрование - V3 =
 | |||
 | |||
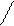 т.е. 1 мл 0,1 моль/л раствора KMnO4 окисляет 0,0152 грамма FeSO4.
т.е. 1 мл 0,1 моль/л раствора KMnO4 окисляет 0,0152 грамма FeSO4.
Вывод: В 100,0 граммах препарата FeSO4 ×7H2O содержится ……….. грамм б/в FeSO4.
Date: 2015-09-24; view: 552; Нарушение авторских прав