
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Результати титрування
|
|
| № розчину | Об’єм розчину Nа2S2O8, що пішов на титрування проби, мл, відібраної через певний час, с | |||||
За даними експерименту будують графік у координатах: об’єм роз-
чину тіосульфату натрію, що пішов на титрування (мл), час (хв), на основі яких оцінюють каталітичний вплив йонів міді та феруму.
3. ДОСЛІДЖЕННЯ ГІДРОЛІЗУ КРОХМАЛЮ
В ПРИСУТНОСТІ СОЛЯНОЇ КИСЛОТИ
Для роботи необхідно: 10% розчин НСl; 10% розчин NaOH; крохмаль; 1% розчин CuSO4; глюкоза; штатив з пробірками; колби на 250 мл; спиртівка.
У колбу із зворотним (повітряним) холодильником налити 30 мл 1% розчину крохмалю, додати 15 мл 10% розчину соляної кислоти, довести до кипіння і кип’ятити протягом 10 хвилин. Обережно охолодити колбу проточною водою. Із вмістом колби (гідролізатом) проробити реакції: а) на крохмаль; б) на глюкозу (реакція Тромера).
а) Відібрати в чисту пробірку 10 крапель гідролізату і додати 1–2 краплі йоду. Поява синього кольору вказує на наявність крохмалю (реакція позитивна), відсутність синього кольору вказує на те, що відбувся гідроліз крохмалю і утворилися продукти гідролізу – мальтоза (реакція негативна).
б) У пробірку налити 5 крапель гідролізату, додати 8 крапель 10% розчину NaOH і сульфату купруму CuSO4 (1% розчин) до появи осаду гідроксиду міді (ІІ) блакитного кольору. Пробірку нагріти на полум’ї пальника. Поява жовтого кольору, що переходить у червоний, свідчить про наявність продуктів гідролізу крохмалю – мальтози і глюкози.
4. ДОСЛІДЖЕННЯ ГІДРОЛІЗУ КРОХМАЛЮ В ПРИСУТНОСТІ ФЕРМЕНТІВ І СОЛЯНОЇ КИСЛОТИ ПРИ ТЕМПЕРАТУРІ 310 К
Для роботи необхідно: розчин крохмалю; розчини ферментів; водяна баня; штатив з пробірками; спиртовий розчин йоду; розчин соляної кислоти.
У 5 пробірок налити по 2 мл розчину крохмалю. В 1 пробірку додати
1 мл слини (або іншого ферменту), розведеної в 2 рази, в 2 – розведеної в
4 рази, в 3 – в 8 раз, в 4 – 1 мл соляної кислоти, в 5 – 1 мл води (5 пробірка служить контролем). Усі пробірки поставити у водяну баню при тем-
пературі 310 К на 10 хвилин. Після охолодження вміст кожної з них розлити у 2 чисті пробірки і проробити реакції на крохмаль з йодом і реакцію Тромера, аналогічно а), б) ІХ.3.
Результати досліджень занести в таблицю:
| № п/п | Субстрат | Ката- лізатор | Темпе-ратура, К | Реакція на крохмаль | Реакція Тромера | Чи відбувається гідроліз? |
5. ВИЗНАЧЕННЯ ШВИДКОСТІ РОЗКЛАДУ ПЕРОКСИДУ ВОДНЮ ГАЗОМЕТРИЧНИМ МЕТОДОМ
Для роботи необхідно: Установка (рис.1.), перексид водню, термостат.
Пероксид водню в водних розчинах повільно розкладається по рівнянню:
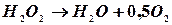 .
.
У присутності катіонів і аніонів деяких органічних речовин, а також ряду твердих речовин розклад перекису водню значно прискорюється. Тому ця реакція у водних розчинах може бути гомогенною або гетерогенною каталітичною реакцією в залежності від взятого каталізатору.
За ходом реакції спостерігають по зміні об’єму кисню, що виділяється через різні проміжки часу від початку реакції.
ПОСЛІДОВНІСТЬ ВИКОНАННЯ РОБОТИ.
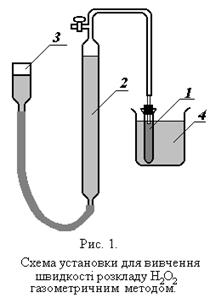 Реакційну посудину 1 наповнити розчином каталізатору таким чином, щоб висота повітряного простору між рівнем рідини і корком не перебільшувала 2 см і помістити його в термостат 4 при певній заданій температурі. Зрівнювальну склянку 3 і бюретку 2 наповнити водою. Рівень води в бюретці встановити на рівні верхнього крану.
Реакційну посудину 1 наповнити розчином каталізатору таким чином, щоб висота повітряного простору між рівнем рідини і корком не перебільшувала 2 см і помістити його в термостат 4 при певній заданій температурі. Зрівнювальну склянку 3 і бюретку 2 наповнити водою. Рівень води в бюретці встановити на рівні верхнього крану.
Після 30 хвилин термостатування в реакційну посудину налити певну кількість пероксиду водню. Розчин ретельно розмішати скляною паличкою і реакційну посудину закрити корком.
Верхній кран на протязі 1-2 хв. тримати відкритим (для витіснення повітря, що виділяється киснем з реакційної посудини), потім його закрити, з’єднавши таким чином реакційну посудину з газовою бюреткою. Встановити одинакові рівні рідини в бюретці і зрівняльній склянці, провести перший вимір і записати рівень на бюретці і час. Кожна послідуюча зміна супроводжується таким записом, причому рівень рідини в бюретці і зрівняльній склянці підтримують одинаковим. Рівень рідини в бюретці записується через 2-5 хв. (чим вище температура, тим менший час між вимірами). Після того, як реакція практично припиниться, реакційну посудину помістити в киплячу водяну баню і витримати в ній до повного розкладу пероксиду водню (біля 30 хв.). Реакція вважається закінченою, якщо рівень газу в бюретці перестає змінюватись. При кип’ятінні на водяній бані зрівняльну склянку тримають у найбільш високому положенні.
Після повного розкладу пероксиду водню реакційну посудину охолодити до температури термостату, витримати в ньому на протязі 25-30 хв. і при одинакових рівнях рідин у бюретці і в зрівняльній склянці заміряти рівень рідини в бюретці.
При обробці експериментальних даних за початок реакції приймати третій або четвертий вимір (тобто вимірювання в умовах режиму, що встановився). Визначають інтервал часу від початку реакції до кожного послідуючого вимірювання t і об’єми кисню, що виділився при проходженні цих інтервалів аt.
По одержаних даних побудувати графіки залежності:
1.Рівності об’ємів кисню від часу (час у хвилинах).
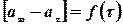 .
.
2.Тобто 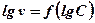 , по якому знаходять порядок реакції.
, по якому знаходять порядок реакції.
3.Логарифму швидкості реакції через різні проміжки часу від логарифму різниці об’ємів кисню, що виділився 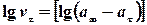 .
.
Далі проводять обрахунок величини константи швидкості реакції за рівнянням
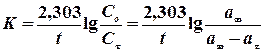 ,
,
де а¥ - об’єм кисню, що виділився після розкладу пероксиду водню (визначається як різниця рівней у бюретці в момент, прийнятий за початок реакції, і після кипіня Н2О2 до повного розкладу). Результати представити у вигляді 4-х графіків і таблиці.
Температура досліду___________
Каталізатор___________________
Кількість перекису водню_______
| № вимі-рювань | Час вимі-рюваня, с | Час від початку реакції, с | Рівень рідини в бюретці, мл | Об’єм газу, що виділи-вся, м3 | Швид-кість реакції | 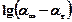
|  
| 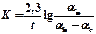
| К |
6. ФОТОХІМІЧНИЙ РОЗКЛАД Н2О2
Для роботи необхідно: установка (рис.1), перексид водню.
Фотохімічний розклад Н2О2 являється типовим ланцюговим процесом, механізм якого можна представити таким чином:
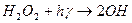 - реакція зародження ланцюга;
- реакція зародження ланцюга;
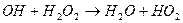 - цикл регенерації;
- цикл регенерації;
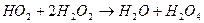
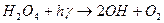 - реакція розгалуження;
- реакція розгалуження;
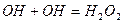 - реакція обриву ланцюга.
- реакція обриву ланцюга.
Виділення кисню відбувається в результаті реакції
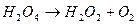
Ця реакція відноситься до ланцюгових реакцій з „виродженими розгалуженнями”. В даному процесі розгалуження здійснюється фотохімічно за рахунок підводу енергії ззовні. Відносно стійким проміжним продуктом являється вільний радикал ОН-. Кінетика цієї реакції виражається рівнянням: 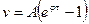 , де
, де
φ - константа наростання, що характеризує швидкість розгалуження;
τ – час.
Логарифмування його дає 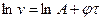 . Це рівняння прямої в системі координат
. Це рівняння прямої в системі координат 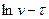 .
.
Перед початком роботи необхідно по термодинамічним функціям розрахувати теплові ефекти елементарних стадій реакції та оцінити принципову можливість їх здійснення. Робота проводиться на установці, схема якої приведена на рис.1.
Послідовність виконання роботи
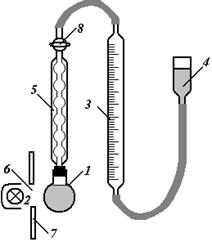 Рис. 1. Схема установки для вивчення кінетики фотохімічного розкладу Н2О2
Рис. 1. Схема установки для вивчення кінетики фотохімічного розкладу Н2О2
|
Установка складається з кварцової колби 1, яка пропускає ультрафіолетові промені, зворотнього холодильника 5, градуйованої газової бюретки 3, зрівнювальної склянки 4 та ртутнокварцевої лампи 2. Кварцеву колбу 1 з розчином Н2О2 зєднати із зворотним холодильником 5 і встановити проти отвору 6 і захисного щитка 7. Відкрити кран 8 і рівень рідини в бюретці 3 при допомозі зрівнювальної склянки 4 поставити на нуль. Пустити воду в холодильник і дочекати моменту, коли встановиться рівень рідини в газовій бюретці при закритому крані 8. Рівень рідини, що змінився в бюретці, встановити відкриттям крану 8. Цим досягається сталість тиску, що рівний атмосферному. Після вирівнювання рівней при закритому крані 8 включається одночасно ртутнокварцева лампа і секундомір. Перший підрахунок записати після того, коли виділяться 1,0 -1,5 см3 кисню, потім через 3 хв., коли швидкість виділення газу досягне 1 см3/хв., підрахунки вести через хвилину. При підрахунку об’єму газу  , необхідно вирівняти рівні рідин в зрівнювальній склянц і газовій бюретці.
, необхідно вирівняти рівні рідин в зрівнювальній склянц і газовій бюретці.
Дослід припинити, коли виділиться 75-100 см3 газу. Дослідні дані записати в таблицю:
| № вимірювань | Час від початку р-ції, с | Покази бюретки | Об’єм О2, що виділився,м3 | Швидкість р-ції, м/с | lgv |
При обробці експериментальних даних побудувати графік в системі координат 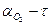 . Ця залежність необхідна для розрахунку швидкості. Швидкість у різні моменти часу визначається
. Ця залежність необхідна для розрахунку швидкості. Швидкість у різні моменти часу визначається
 .
.
Інтервал часу 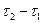 брати рівним 2 хвилини. Аналітична залежність швидкості від часу виражається рівнянням
брати рівним 2 хвилини. Аналітична залежність швидкості від часу виражається рівнянням
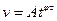 , що в логарифмічній формі
, що в логарифмічній формі 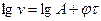 .
.
Для знаходження емпіричних констант А і φ побудувати графік залежності v і τ і по наростаючій кривій взяти значення v в різні моменти часу і накреслити графік у системі координат 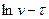 .
.
Величина φ визначається як тангенс кута нахилу одержаної прямої до осі τ, а 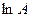 - як відрізок, що відтинається прямою на осі
- як відрізок, що відтинається прямою на осі 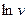 при значенні
при значенні 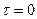 .
.
Х. ФІЗИКОХІМ ІЯ ДИСПЕРСНИХ СИСТЕМ.
1. МЕТОДИ ОДЕРЖАННЯ КОЛОЇДНИХ РОЗЧИНІВ
Колоїдним розчином або золем називається система, яка склада-
ється з частинок дисперсної фази розміром 10–9–10–7 м або 10–7–10-5 см дисперсійного середовища.
Частинки дисперсної фази можуть бути твердими (кристалічними або аморфними), рідкими і газоподібними.
На сьогодні встановлено, що будь-яку речовину можна одержати у вигляді колоїдного розчину, якщо підібрати відповідні умови досліду.
І. ПРИГОТУВАННЯ ЗОЛЮ БЕРЛІНСЬКОЇ ЛАЗУРІ
Для роботи необхідно: розчини 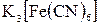 (концентрації 0,1 г/л та 20 г/л); 2%
(концентрації 0,1 г/л та 20 г/л); 2% 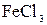 ; колби на 50 мл – 2 шт.; мірні піпетки.
; колби на 50 мл – 2 шт.; мірні піпетки.
Готують 20 мл розбавленого розчину гексаціаноферату калію 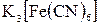 концентрації 0,1 г/л і по краплях додають 1–2 мл 2%-ного розчину хлориду заліза (ІІІ).
концентрації 0,1 г/л і по краплях додають 1–2 мл 2%-ного розчину хлориду заліза (ІІІ).
Для порівняння готують 20 мл розчину гексаціаноферату калію кон-
центрації 20 г/л і додають 10–20 мл 2%-ного розчину хлориду заліза (ІІІ).
Висновки і спостереження записують у журнал.
ІІ. ПРИГОТУВАННЯ ЗОЛЮ КАНІФОЛІ
Для роботи необхідно: 2% розчин каніфолі в етиловому спирті; дистильована вода; колба на 100–250 мл.
Готують 2%-ний розчин каніфолі в етиловому спирті. По краплях при енергійному перемішуванні (струшуванні) приливають його у великий об’єм дистильованої води (з розрахунку 5 мл спиртового розчину каніфолі на 50 мл води). Утворюється прозорий, сильно опалесціюючий ліофобний золь каніфолі у воді.
Частинки каніфолі в цьому розчині заряджені негативно.
ІІІ. ПРИГОТУВАННЯ ГІДРОЗОЛЮ СІРКИ
Для роботи необхідно: 2% розчин сірки в спирті; дистильована вода; колба на 50–100 мл.
Заздалегідь готують розчин сірки в етиловому спирті, періодично збов-
туючи сірку в спирті. Залишок сірки, яка не розчинилась, відфільтровують.
Гідрозоль сірки одержують, доливаючи по краплях 5 мл її спир-
тового розчину до 20 мл дистильованої води. Будова міцели сірки в цьому розчині невідома. Частинки сірки зарядженні негативно.
ІV. ПРИГОТУВАННЯ ЗОЛЮ ГІДРОКСИДУ ЗАЛІЗА
Для роботи необхідно: 2% розчин 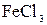 ; мірні циліндри на 30 і 200 мл; колба на 250 мл; 8 колб на 25 мл; розчин солі К2SO4; розчин солі
; мірні циліндри на 30 і 200 мл; колба на 250 мл; 8 колб на 25 мл; розчин солі К2SO4; розчин солі 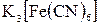 .
.
Цей метод застосовується, в основному, для одержання золів гідро-
ксидів важких металів. Суть його полягає в слідуючому: в колбі нагрі-
вають до кипіння 200 мл дистильованої води і в неї додають окремими порціями 30 мл 2%-ного розчину 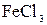 . Спочатку одержується гідрат оксиду феруму (ІІІ) по схемі (за рівнянням реакції):
. Спочатку одержується гідрат оксиду феруму (ІІІ) по схемі (за рівнянням реакції):
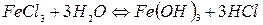
Молекули  вступають у хімічну взаємодію з НСl:
вступають у хімічну взаємодію з НСl:
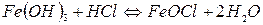
Молекули 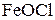 дисоціюють на йони:
дисоціюють на йони:
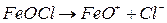
На поверхні колоїдної частинки із розчину адсорбуються ті йони, які за своєю природою близькі до складу ядра. Тоді будову колоїдної частинки золю гідроксиду феруму (ІІІ) схематично можна зобразити так:
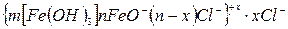
2. КОАГУЛЯЦІЯ КОЛОЇДНИХ РОЗЧИНІВ ЕЛЕКТРОЛІТАМИ
Одержаний і охолоджений до кімнатної температури золь гідроксиду феруму (ІІІ) розливають у 8 колбочок по 20 мл в кожну.
Золь  в перших двох колбочках титрують розчином К2SO4, золь інших двох колбочок – розчином
в перших двох колбочках титрують розчином К2SO4, золь інших двох колбочок – розчином 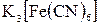 до початку коагуляції, що спостерігають до помутніння золю.
до початку коагуляції, що спостерігають до помутніння золю.
В чотири наступні колбочки наливають 0,5%-ний розчин желатини по 10 крапель і теж титрують розчинами К2SO4 і 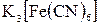 . В цьому випадку електролітів йде більше. Це вказує на те, що желатина підвищує стабільність колоїдів, виявляючи захисну дію.
. В цьому випадку електролітів йде більше. Це вказує на те, що желатина підвищує стабільність колоїдів, виявляючи захисну дію.
Результати титрування записують в таку таблицю:
| Номери колбочок | К2SO4, 10-6м3 | Номери колбочок | K3[Fe(CN)6], 10-6м3 | |
| Без желатини | ||||
| З желатиною |
3. ВИЗНАЧЕННЯ ВЕЛИЧИНИ ЕЛЕКТРОКІНЕТИЧНОГО
ПОТЕНЦІАЛУ МЕТОДОМ ЕЛЕКТРОФОРЕЗУ
Для роботи необхідно: прилад для електрофорезу; вольтметр; золь гідроксиду заліза (ІІІ); 0,001 н. розчин NaOH.
Величину електрокінетичного потенціалу можна визначити, викорис-
товуючи електрофорез – рух мікроскопічних частинок, завислих у воді, під впливом постійного струму. Це явище першим спостерігав у 1807 р. про-
фесор Московського університету Ф.Ф. Рейсс.
 Прилад для електрофорезу являє собою U-подібну скляну трубку
Прилад для електрофорезу являє собою U-подібну скляну трубку
(див. рисунок) з двома кранами 1 і 2. Знизу ця трубка з’єднана за допомогою крана 3 з трубкою 6, яка переходить у лійку. Прилад заповнюють через лійку колоїдним розчином при відкритих кранах, після чого закривають кришкою лійку, закручують всі крани і надлишок колоїдного розчину з обох колін U-подібної трубки зливають. Потім в обидва коліна наливають прозорий незафарбований електроліт (бокову рідину), електропровідність якого повинна дорівнювати електропровідності колоїдного розчину. Далі відкривають крани 1 і 2 і повільно – кран 3. При цьому колоїдний розчин піднімається вище кранів, а розчин електроліту піднімається до тих пір, поки в нього не зануряться електроди 4. Тоді кран 3 закривають. Між зафарбованим золем і електролітом повинна встановитись чітка межа (границя). Вмикають джерело постійного струму 8 і спостерігають пере-
міщення границі зафарбованого золю по шкалі 5, точно відзначаючи час початку й кінця досліду і відповідний шлях переміщення золю S.
За допомогою гнучкої дротини вимірюють відстань (середню) між електродами і обчислюють середню величину градіента потенціалу
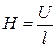 .
.
Величину U визначають за вольтметром 7.
Величину x- потенціалу обчислю-
ють за формулою:
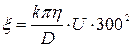 (1)
(1)
де D – діелектрична стала рідини;
h – в’язкість рідини, Н×с/м2;
k – стала, яка залежить від форми частинок;
U – електрофоретична швидкість, що дорівнює шляху (м), який про-
ходять частинки за 1 с при градієнті потенціалу Н величиною В на 0,01 м. Для золів гідроксиду заліза і берлінської блакиті величина k = 4 (для глобулярних частинок).
Величину електрофоретичної швидкості U визначають за формулою
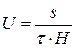 , (2)
, (2)
де S – шлях, м, який пройшли частинки за час Т, с.
Як джерело постійного струму використовують батарею гальванічних елементів напругою 60–80 В. Можна використати змінний струм, підклю-
чивши випрямляч.
Для дослідів зазделегідь готують золь гідроксиду заліза і віддіалі-
зовують його, як бокову рідину використовують розчин хлориду амонію концентрацією 1 г/л.
Заготовлений золь гідроксиду розливають у 4 посудини по 25–50 мл у кожну і додають в першу 0,001 н. розчину їдкого натру, у другу 10 мл, у третю – 5 мл.
Замість золю гідроксиду заліза можна використати будь-який забарв-
лений золь (наприклад, берлінської блакиті).
Якщо застосовують прилад тільки з одним краном (без кранів 1 і 2
U-подібної трубки), то колоїдний розчин наливають у прилад з закритим краном так, щоб тонка трубка і лійка заповнились ним. Потім наливають в U-подібну трубку 6–10 мл бокової рідини, вставляють платинові електроди так, щоб вони були на відстані 5–6×10–2 м від верхніх країв U-подібної трубки. Потім обережно трохи відкривають кран, щоб золь повільно перетікав у U-подібну трубку. При цьому повинна зберігатися чітка межа поділу між забарвленим золем і боковою рідиною. Коли бокова рідина досягне 1/2–3/4 платинових електродів, кран закривають.
Результати дослідів записують у таку таблицю:
| № розчину | Тривалість електрофорезу, с | Шлях, що пройшла границя забарвленого золю,10-3 м | Напруга, U, В |
4. ВИВЧЕННЯ ІЗОЕЛЕКТРИЧНОЇ ТОЧКИ БІЛКІВ
Для роботи необхідно: розчини: 0,01н. СН3СООН; 0,1 н. СН3СООН; 1 н. СН3СООН; 0,1 н. СН3СООNa; розчин казеїну в 0,1 н. CH3COOONa; індикатор метилоранж; піпетка, градуйована на 10 мл; штатив з пробір-
ками.
Білки, які складають основу протоплазми, мають ряд властивостей, що витікають з їх специфічної хімічної природи.
Молекули білків являють собою довгі ланцюги типу полімерів, що складаються з багатьох амінокислот.
Спрощену схему структури білкової молекули можна представити таким чином:
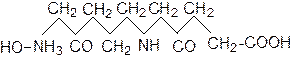 |
Зі схеми видно, що молекула білка поряд з вуглеводневим радикалом містить значну кількість полярних гідрофільних груп: –СООН; –NH2; =СО; =NH.
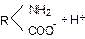 У зв’язку з цим білки мають високогідрофільні властивості. При-
У зв’язку з цим білки мають високогідрофільні властивості. При-
сутність основної групи –NH2 і кислотної –СООН зумовлюють амфотерні властивості білкової молекули, яка має основні властивості, коли пере-
важає вплив аміногрупи, і кислотні, коли переважає вплив
карбоксильної групи
У водних розчинах білки проявляють властивості слабих електролітів. В цьому випадку проходить дисоціація і основної, і кислотної групи.
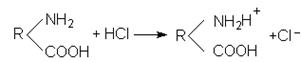
В кислому середовищі дисоціація карбоксильних груп понижується водневими йонами, які присутні в надлишку. При цьому білкова молекула заряджається позитивно. Наприклад, в присутності соляної кислоти про-
ходить реакція:
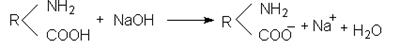
В лужному середовищі внаслідок надлишку іонів ОН– понижується дисоціація основної групи –NH2 і білкова молекула заряджається нега-
тивно.
Отже, при певній концентрації водневих йонів (тобто при певному значенні рН середовища) кількість йонізованих основних груп і сумарний заряд частинки буде рівним нулю, тобто система буде знаходитись в ізоелектричному стані. Концентрація водневих йонів, виражена величиною водневого показника рН, при якій молекула білка знаходиться в ізоелек-
тричному стані, називається ізоелектричною точкою.
Для кожного білка існує певне значення рН, при якому він знахо-
диться в ізоелектричному стані. Для більшості білків їх ізоелектрична точка лежить в кислому середовищі при рН<7.
Це пояснюється тим, що на поверхні білкової молекули переважають кислотні групи, константа дисоціації яких набагато більша від константи дисоціації основних груп. Так як в ізоелектричній точці по всій довжині молекули розташовується однакова кількість протилежно заряджених ос-
новних і кислотних груп, то внаслідок електростатичних сил притягування молекула білка скручується в клубочок, стає більш компактною, густина її збільшується. Властивості, зв’язані з формою і зарядом макромолекули, при цьому змінюються. Так, наприклад, в ізоелектричному стані в’язкість, набухання, розчинність білків зменшуються. На пониженні розчинності білків в ізоелектричному стані ґрунтується методика визначення ізоелек-
тричної точки казеїну.
При виконанні практичної частини роботи беруть штатив на 18 про-
бірок – два ряди по 9 пробірок.
Згідно нижче приведеної таблиці в усі 18 пробірок за допомогою гра-
дуйованої піпетки заливають дистильовану воду, 0,01 н.; 0,1 н.; 1 н. роз-
чини оцтової кислоти. До пробірок першого ряду доливають по 1 мл свіжо приготовленого казеїну в 0,1 н. розчині оцтовокислого натрію. До пробірок другого ряду доливають по 1 мл 0,1 н. розчину оцтовокислого натрію і індикатор метилоранж. При цьому одержуємо буферні суміші з різними значеннями рН, причому в обох рядах пробірок склад буферних сумішей однаковий.
Розчинність казеїну залежить від рН середовища і в ізоелектричному стані вона найменша. Це спостерігається в найбільшому помутнінні розчину. Отже, значення рН в пробірці, де помутніння розчину казеїну найбільше, відповідає ізоелектричній точці казеїну.
Очевидно, перехід забарвлення метилоранжу від оранжевого до чер-
воного в пробірках другого ряду повинен співпадати з пробіркою най-
більшого помутніння в першому ряді.
| Номер пробірок | |||||||||
| Дистильована вода, 10-6м3 | 8,3 | 7,8 | 8,7 | 8,5 | 8,0 | 7,0 | 5,0 | 1,0 | 7,4 |
| 0,01 н. СН3СООН, 10-6м3 | 0,7 | 1,2 | – | – | – | – | – | – | – |
| 0,1 н. СН3СООН, 10-6м3 | – | – | 0,3 | 0,5 | 1,0 | 2,0 | 4,0 | 8,0 | – |
| 1 н. СН3СООН, 10-6м3 | – | – | – | – | – | – | – | – | 1,6 |
| Величина рН | 5,2 | 5,6 | 5,3 | 5,0 | 4,7 | 4,4 | 4,1 | 3,8 | 3,5 |
Другий ряд пробірок являється контрольним. Перехід забарвлення індикатора від основного до кислого середовища повинен лежати в межах ізоелектричної точки казеїну. Для метилоранжу цей перехід лежить в межах рН = 2,7 – 4,7.
Через 5 – 10 хв. в ряді пробірок, які містять казеїн, зазначають ступінь помутніння. Відсутність помутніння позначають знаком “–”, його наяв-
ність – знаком “+”. Ступінь помутніння позначають різною кількістю знаків плюс або мінус (до трьох). В другому ряді пробірок відзначають забарвлення метилоранжу – “о”; перехід забарвлення – “п”; червоне –“ч”.
Результати роботи перевіряються керівником занять. Значення рН, що відповідає ізоелектричній точці казеїну записують.
5. НАБУХАННЯ ГЕЛІВ
Для роботи необхідно: желатин; 0,1 н. розчин СН3СООН; 0,1 н. роз-
чин СН3СООNa; штатив з пробірками; піпетка, градуйована на 10 мл.
Поглинання рідини студнем або гелем, що супроводжується значним збільшенням його об’єму, називається набуханням.
Процес набухання є характерною властивістю гелів у таких високомо-
лекулярних сполук, як желатина, агар-агар, каучук, що називаються елас-
тичними гелями, на противагу ненабухаючим – нееластичним гелям, до яких належать, головним чином, неорганічні гелі типу SiO2, SnO2, TiO2. Подібні гелі можуть вбирати змочуючу їх рідину. Проте їх об’єм при цьому не змінюється.
Характерною рисою високомолекулярних сполук являється асиметрія форми ниткоподібних макромолекул, що мають великі розміри ланцюгів.
Властивість еластичного гелю зв’язана з пружністю ланцюгів макро-
молекул, з яких складається основа гелю. Пружність макромолекул зале-
жить від природи атомів, що входять до складу макромолекул, від харак-
теру розподілу цих атомів, від довжини ланцюга, величини міжмоле-
кулярних сил та від температури.
Процес набухання можна уявити як проникнення молекул низькомо-
лекулярного розчинника в простір між молекулами високомолекулярної сполуки. Коли вільний простір заповнюється рідиною, молекули розчин-
ника починають розширяти ланки ланцюга полімеру, утворюючи нові пус-
тоти, які знову заповнюються низькомолекулярною рідиною. У цьому ви-
падку, коли набухлий гель далі самовільно переходить в розчин при тій же температурі, проходить необмежене набухання.
Так натуральний каучук у воді набухає, а потім переходить в розчин, утворюючи розчин високомолекулярної сполуки. У даному випадку прохо-
дить розширення ланцюгів полімеру.
Гелі желатини і агар-агару при звичайній температурі набухають у воді до певної межі і в розчин не переходять. Розширення ланцюгів прохо-
дить тільки на деяких ділянках, остання частина ланцюга залишається зв’язаною між собою. У цьому випадку проходить обмежене набухання при даній температурі. Підвищення температури приводить часто до того, що обмежено набухаючі студні починають розчинятися, як це спосте-
рігається у випадку желатини. Однак, не завжди підвищення температури приводить до розчинення, наприклад, не наступає розчинення вулкані-
зованого каучука. Це пояснюється наявністю між молекулами “мостикових зв’язків”, що затруднюють перехід макромолекул в розчин. При наявності великої кількісті таких “мостикових зв’язків”, наприклад ебоніту, прос-
торова сітка полімеру стає твердою, ланцюги втрачають свою пружність і полімер втрачає свою здатність до набухання.
Початкова стадія набухання характеризується значним виділенням тепла – теплотою набухання і тиском набухання. Сума об’ємів сухого гелю і поглиненої ним рідини більша, ніж об’єм набухлого гелю. Це явище носить назву контракції. Воно спостерігається, головним чином, у гелів, що набухають у воді (желатина, агар-агар, крохмаль) і пояснюється відносно більшою густиною орієнтованих молекул зв’язаної води. Набухання в органічних розчинниках проходить без помітної контракції.
Кількість рідини, що поглинається одним грамом гелю, називається ступенем набухання.
При необмеженому набуханні кількість рідини, що поглинається, може бути дуже великою і перевищувати десятикратний об’єм взятого для набухання гелю. Процес набухання проходить з певною швидкістю, зале-
жить від природи набухаючого геля і розчинника. Набухання проходить як реакція першого порядку.
Велику групу, що мають ряд особливостей при набуханні, пред-
ставляють гелі білкових речовин у воді і водних розчинах. В цих умовах при вимірюванні ступеня набухання необхідно врахувати рН середовища.
При певній концентрації водневих йонів від макромолекули білка від-
щеплюються йони, що відповідають як кислотній, так і основній дисо-
ціації. Лише при певному значенні рН наступає такий стан, який харак-
теризується наявністю рівної кількості позитивних і негативних зарядів; білок стає електронейтральним. Такий стан називається ізоелектричним, а рН розчину, при якому цей стан наступає – ізоелектричною точкою.
Крива залежності ступеня набухання від рН має мінімум в ізо-
електричній точці. Причина впливу водневих і гідроксольних йонів на ступінь набухання полягає в тому, що в ізоелектричному стані частинки макромолекул з’єднуються в більш складні і великі комплекси. Цей процес зумовлюється деякою десольватацією ланцюгів полімерів в ізоелектрич-
ному стані.
Хід виконання роботи
Для виконання роботи в пробірках готують 6 буферних розчинів (див. табл. 1):
В градуйовані пробірки насипають по 0,1×10–3кг сухого порошку желатини, точно відзначають об’єм сухої речовини в пробірках. Потім в кожну з пробірок вливають 5 мл одного з приготовлених розчинів з відповідним значенням рН. Через годину замірюють об’єм набухлої желатини. Ступінь набухання розраховують за формулою:
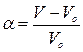 .
.
Таблиця 1
| Склад розчинів | Номери пробірок | |||||
| 0,1 н. СН3СООН, 10-6м3 | – | |||||
| 0,1 н. СН3СООNa, 10-6м3 | – | |||||
| Н2О дист., 10-6м3 | – | – | – | – | – | |
| Значення рН | 3,8 | 4,4 | 4,7 | 5,0 | 5,6 |
Дані експерименту записують у табл. 2.
Таблиця 2
| Склад розчину | Номери пробірок | |||||
| рН буферного р-ну | 3,8 | 4,4 | 4,7 | 5,0 | 5,6 | 7,0 |
| Об’єм желатини до набухання, Vo, 10-6м3 | ||||||
| Об’єм набухлої желатини, V, 10-6м3 | ||||||
| Ступінь набухання, W,% |
ХІ. БІОГЕННІ ЕЛЕМЕНТИ
s-Елементи та їх сполуки
З s-елементів до біометалів відносяться натрій, калій, магній та каль-
цій. Їх йони входять у склад буферних систем організму, забезпечують необхідний осмотичний тиск, беруть участь в утворенні мембранних по-
тенціалів, у передачі нервових імпульсів (Na+, K+), структуроутворенні (Мg2+, Ca2+). Такі s-елементи, як берилій, барій, мають дуже токсичні властивості. Знання фізико-хімічних основ s-елементів та їх сполук має важливе значення в діагностиці, профілактиці та лікуванні хвороб, виз-
ваних надлишком або недостачею s-елементів в організмі.
1. АНАЛІТИЧНІ РЕАКЦІЇ НА ЙОНИ s-ЕЛЕМЕНТІВ
Визначення йона Na+ по кольору полум’я
Очищену промиванням у концентрованому розчині соляної кислоти і прокалюванням на безкольоровому вогні горілки платинову (або ніхро-
мову) проволоку обмокують у розчині хлориду натрію, а потім вносять у безкольоровий вогонь горілки. Спостерігається забарвлення вогню в жов-
тий колір.
Забарвлення вогню, тобто здатність атомів збуджуватись і випускати кванти світла визначеної довжини хвилі при прокалюванні солей міне-
ральних речовин на вогні, використовується в методі полум’яної фотометрії для визначення йонів натрія в плазмі крові, еритроцитах, сечі та тканинах.
Визначення йонів K+ по кольору полум’я
Краплю розчину солі калію вносять на кінчику платинової дротини (попередньо дротину очистити концентрованою соляною кислотою та про-
калити) у безкольорове полум’я спиртівки та спостерігають зміну забарв-
лення полум’я у фіолетовий колір. Так визначають наявність йонів калію в біологічних рідинах та тканинах. Ефект забарвлення полум’я використо-
вується в методі фотометрії.
Визначення хлор-йонів Cl– в питних водах за методом Фольгарда
В питних водах йони хлору знаходяться у вигляді солей: NaCl, KCl, CaCl2, MgCl2.
Аргентометричний метод дає позитивні результати, якщо у воді знаходиться не більше 2–3 г хлор-йона в 1 мл.
Для визначення вмісту хлор-йона в питній воді переносять піпеткою в колбу для титрування 10 мл досліджуваної води, додають 10 мл титро-ваного розчину нітрату аргентуму, 1 мл насиченого розчину ферумамо-
нійних галунів та титрують розчином NH4CSN до появи рожевого забарв-
лення, титрування повторюють 2–3 рази.
Вміст хлор-йона розраховують за формулою:
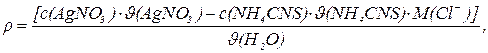
де r(Cl–) – масова концентрація хлор-йона, мг/л;
M(Cl–) – молярна маса йонів хлору, мг/моль;
J(H2O) – об’єм досліджуваної води, л;
с(AgNO3) – молярна концентрація розчину AgNO3, моль/л;
с(NH4CNS) – молярна концентрація розчину NH4CNS, моль/л;
J(AgNO3) – об’єм титрованого розчину AgNO3, л;
J(NH4CNS) – об’єм титрованого розчину NH4CNS, л.
2. АНАЛІТИЧНІ РЕАКЦІЇ НА р-ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
Серед р-елементів п’ять елементів є органогенними (“елементи жит-
тя”): вуглець, азот, кисень, фосфор, сірка, які складають основу біологічно важливих молекул. До біогенних елементів відносяться також хлор та йод, а бор, фтор та бром наявні в живих організмах у мікрокількостях. Сполуки плюмбуму та арсену мають дуже токсичні властивості. Як правило, в живому організмі р-елементи входять до складу складних органічних макромолекул або йонів OH–, Cl–, 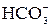 ,
, 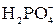 ,
, 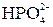 ,
, 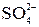 , F–. Вони складають основу буферної системи крові, забезпечують необхідний осмо-
, F–. Вони складають основу буферної системи крові, забезпечують необхідний осмо-
тичний тиск, містяться в шлунковому соці та інших біологічних середови-щах. Багато сполук р-елементів використовуються в якості лікарських засобів.
Реакція на бор (ІІІ) по кольору полум’я
У фарфоровій чашці випаровують 5–6 крапель розчину бури. Після охолодження до сухого залишку добавити 4–5 крапель концентрованого розчину Н2SO4 та 5–6 крапель етилового спирту. Суміш перемішати скляною паличкою та підпалити. Полум’я спирту, який горить, забарв-
люється в зелений колір. Це забарвлення обумовлене летким етиловим ефіром борної кислоти В(ОС2Н5)3. Його отримують дією сірчаної кислоти та етилового спирту на тетраборат натрію:
Na2B4O7 + H2SO4 + 5H2O = 4H3BO3 + Na2SO4
H3BO3 + 3C2H5OH = B(OC2H5)3 + 3H2O,
За допомогою цих реакцій перевіряються такі лікарські препарати, як борна кислота та ії солі.
Реакція на йон 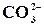 з розведеними кислотами
з розведеними кислотами
У пробірку налити 0,5 мл розчину Na2CO3 або K2CO3 та додати туди 1–2 краплі розчину кислоти. Що при цьому спостерігається? Написати рівняння реакції в молекулярній та йонній формі. Ця реакція вико-
ристовується в санітарно-гігієнічній практиці при визначенні таких ком-
понентів, як СО  та HCO
та HCO 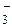 у звичайних та стічних водах.
у звичайних та стічних водах.
Реакція на йон Pb2+ з йодидом калію
До декількох крапель розчину солі плюмбуму прилити стільки ж розчину йодиду калію. Випадає жовтий осад йодиду плюмбуму.
Pb(NO3)2 + 2KI = PbI2 + 2KNO3
Pb2+ + 2I– = PbI2
До осаду прилити 1 мл оцтової кислоти та суміш нагріти до кипіння. Розчин повільно охолоджується. При цьому знов випадає осад йодиду плюмбуму у вигляді золотистих зерен.

Реакція на йон 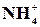 з реактивом Несслера
з реактивом Несслера
На предметне скло нанести на відстані (0,5–1)×10–2 м один від одного по одній краплі розчину NH4Cl та реактиву Несслера. З’єднати краплі за допомогою скляної палички – випадає червонувато-бурий осад:
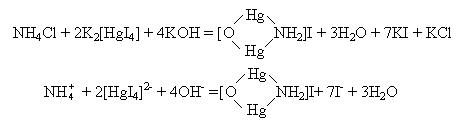
При дуже малих кількостях солей амонію замість осаду утворюється жовтий розчин. Цей ефект використовується у колориметричному методі аналізу для визначення загального та залишкового азоту крові, сечовини, у санітарно-гігієнічній практиці – при аналізі води, повітря, харчових про-
дуктів.
Реакція на йон 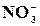 з сульфатом феруму (ІІ) в присутності концентрованої сірчаної кислоти
з сульфатом феруму (ІІ) в присутності концентрованої сірчаної кислоти
На предметне скло нанести краплю розчину нітрату натрію, у середи-
ну краплі помістити маленький кристалик FeSO4×7H2O. На нього нанести одну краплю (за допомогою крапельниці) концентрованої соляної кислоти. Навколо кристалика з’являється буре забарвлення:
3 FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 4H2O + 2NO
3Fe2+ + 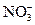 + 4H+ = 3Fe3+ + 2H2O + NO
+ 4H+ = 3Fe3+ + 2H2O + NO
FeSO4 + NO = [ Fe(NO)]SO4
Fe2+ + NO +  = [Fe(NO)]SO4
= [Fe(NO)]SO4 
Реакція на йон 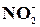 з йодидом калію
з йодидом калію
Краплю розчину нітриту калію або натрію розбавити до 3 мл водою, а потім добавити по одній краплі розчинів КІ, сірчаної кислоти та декілька крапель розчину крохмалю. Що при цьому бачимо?
Рівняння реакції:
2NaNO2 + 2NaI + 2H2SO4 = 2NO + I2 + 2H2O + 2Na2SO4
2NO2- + 2I- + 4H+ = 2NO + I2 + 2H2O
Реакція використовується для перевірки фармакопейного препарату NaNO2.
Реакція на йон 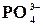 з молібдатом амонію
з молібдатом амонію
У пробірку налити 0,5 мл розчину Na2HPO4 та 0,5 мл розчину (NH4)2MoO4. Суміш підігріти. Що бачимо при охолодженні? Рівняння реакції:
12(NH4)2MoO4 + Na2HPO4 + 23HNO3 = (NH4)3H4[P(Mo2O7)6] +
+ NaNO3 + 10H2O + 21NH4NO3
Вказана реакція застосовується для визначення фосфору в ортофос-
фатах, які розчинені у водах промислових відходів.
(Для визначення фосфору в біологічних рідинах використовується реакція з молібденовою кислотою за присутністю якогось відновлювача).
Аналітична реакція на арсен (ІІІ)
Ця реакція базується на отриманні гідроген арсену (ІІ), який віднов-
лює солі аргентуму до металічного срібла. У пробірку налити 0,5 мл роз-
чину розбавленої сірчаної кислоти та краплю розчину солі арсену. Щіль-
но закрити пробірку фільтрувальним папером, змоченим 1–2 краплями розчину нітрату аргентуму, потім, трохи піднявши папір, внести у про-
бірку кусок гранульованого цинку і знову швидко закрити отвір пробірки. Через декілька хвилин на внутрішній стороні фільтрувального паперу з’являється характерна пляма жовтого, коричневого або чорного кольору – в залежності від концентрації арсена в розчині:
2Na3AsO3 + 6Zn + 9H2SO4 = 2AsH3 + 6ZnSO4 + 3Na2SO4 + 6H2O
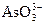 + 3Zn +9H+ = AsH3 + 3Zn2+ + 3H2O
+ 3Zn +9H+ = AsH3 + 3Zn2+ + 3H2O
AsH3 + 6AgNO3 + 3H2O = H3AsO3 + 6Ag +6HNO3
AsH3 + 6Ag+ + 3H2O = H3AsO3 + 6Ag +6H+
Ця реакція використовується для визначення арсену в біологічних матеріалах та водах, забруднених промисловими відходами.
Реакція на йон Ві3+ з йодидом калію
До 0,5 мл розчину солі бісмуту добавити 2–3 краплі розчину КІ. Ви-
падає чорно-коричневий осад йодиду бісмуту:
Ві(NO3)3 + 3KI = BiI3 + 3KNO3
Bi3+ + 3I– = BiI3
До одержаного осаду прилити ще (надлишок) розчину КІ та збовтати. Осад розчиняється з утворенням комплексної солі оранжевого кольору:
BiI3 + KI = K[BiI4]
BiI3 + I– = [BiI4]–
Реакція використовується для перевірки фармакопейного препарату ВіONO3.
Реакція на йон 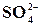 із розчином хлориду барію
із розчином хлориду барію
У пробірку налити 5 мл розчину K2SO4, Na2SO4 або H2SO4 та 1 мл розчину ВаСl2. Скласти рівняння реакції. Впевніться, що осад, який утворюється, не розчинний у HNO3 і HCl.
Реакція використовується для визначення йонів 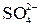 в звичайних та стічних водах.
в звичайних та стічних водах.
Реакція на йон 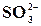 із розчином мінеральної кислоти
із розчином мінеральної кислоти
У пробірку налити 0,5 мл розчину K2SO3 або Na2SO3, 1 мл розчину HCl та нагріти. Виділяється сірчистий газ з характерним запахом. Записати рівняння цієї реакції.
Реакція на йон 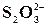 із розчином мінеральної кислоти
із розчином мінеральної кислоти
У пробірку налити 0,5 мл розчину Na2S2O3 та 1 мл розчину HCl. Трохи підігріти. Що при цьому бачимо? Рівняння реакції:
Na2S2O3 + 2HCl = S + SO2 + H2O
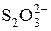 +2H+ = S +SO2 + H2O
+2H+ = S +SO2 + H2O
Приведена реакція лежить в основі існуючого методу лікування сверблячки.
Реакція на йон 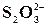 із розчином йоду
із розчином йоду
У пробірку налити 0,5 мл розчину Na2S2O3 та декілька крапель розчину йоду. Розчин йоду знебарвлюється.
2 Na2S2O3 + I2 = Na2S4O6 + 2NaI
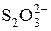 + I2 =
+ I2 =  + 2I–
+ 2I–
За допомогою вказаної реакції встановлюються фармакопейні пре-
парати йоду та тіосульфату.
3. АНАЛІТИЧНІ РЕАКЦІЇ НА ЙОНИ d-ЕЛЕМЕНТІВ
ТА ЇХ СПОЛУКИ
При порівнянні з розглянутими раніше s-елементами, d-елементи міс-
тяться в організмі у значно менших кількостях. Однак їх роль у фізіоло-гічних та патологічних процесах значна. У теперішній час іде дискусія чи рахувати хром та ванадій біометалами. Біометали – незамінні мікро-
елементи, роблять каталітичний вплив на багаточисельні біохімічні реак-
ції, активізують діяльність ферментів. У макрокількостях вони отруйні. Особливу загрозу становлять сполуки меркурію. Сполучають обидві краплі за допомогою скляної палички – утворюється жовтий кристалічний осад:
2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6] + 2NaCl
2K+ + Na+ + [Co(NO2)6]3– = K2Na[Co(NO2)6]
Реактив не може бути застосований в лужному або кислому розчині внаслідок руйнування комплексного йону:
[Co(NO2)6]3– + 3OH– = Co(OH)3 + 6NO 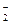
[Co(NO2)6]3– + 6H+ = Co3+ + 6HNO 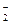
Цією реакцією користуються для осадження йонів калію в біологічних рідинах при перманганатометричному визначенні калію в них (кількість йонів калію в осаді визначається після розчинення шляхом титрування йонів NO 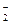 перманганатом калію).
перманганатом калію).
Реакція на йон Mg2+ з гідрофосфатом натрію Na2HPO4 у присутності водного розчину аміаку та хлориду амонію
У пробірку наливають 0,5 мл розчину солі магнію, а потім додають туди у вказаній послідовності по 0,5 мл таких розчинів: NH4Cl, NH3ОН та Na2HPO4. При цьому випадає білий дрібнокристалічний осад подвійної солі MgNH4PO4:
MgCl2 + Na2HPO4 + NH3 = MgNH4PO4 + 2 NaCl
Mg2+ + HPO 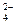 + NH3 = MgNH4PO4
+ NH3 = MgNH4PO4
Присутність NH4Cl в розчині необхідна для того, щоб запобігти утворенню гідроксиду магнію за рівнянням реакції:
Mg2+ + 2NH3 + 2H2O = Mg(OH)2 + 2NH  ,
,
збільшення NH  зміщує дану рівновагу вліво та йони Mg2+, завдяки цьому, залишаються в розчині.
зміщує дану рівновагу вліво та йони Mg2+, завдяки цьому, залишаються в розчині.
Отриманий осад розділити на дві частини та перевірити його роз-
чинність у соляній та оцтовій кислотах. Реакції проходять за рівняннями:
MgNH4PO4 + 3HCl = MgCl2 + NH4Cl + H3PO4
MgNH4PO4 + 3H+ = Mg2+ + 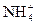 + H3PO4
+ H3PO4
або
MgNH4PO4 + 2CH3COOH = Mg(CH3COO)2 + NH4H2PO4
MgNH4PO4 + 2CH3COOH = Mg2+ + 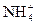 + 2CH3COO- + H2PO
+ 2CH3COO- + H2PO 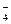
Реакція утворення MgNH4PO4 застосовується в біохімічному аналізі для визначення йонів Mg2+ у крові та тканинах.
Реакція на йон Са2+ з оксалатом амонію (NH4)2C2O4
У пробірку наливають 0,5 мл розчину солі кальцію і таку ж кількість розчину (NH4)2C2O4. Утворюється білий кристалічний осад:
СаСl2 + (NH4)2C2O4 = CaC2O4 + 2 NH4Cl
Ca2+ + C2O42- = CaC2O4
Осад розділяють на дві частини та випробовують його на розчинність в соляній та оцтовій кислотах. В якій кислоті осад розчиниться? Записують рівняння хімічної реакції. Розглянута реакція застосовується для визна-
чення загального вмісту йонів кальцію у крові, сечі та тканинах.
Реакція на йон Ва2+ з хроматом калію К2СrO4
Налити в пробірку 0,5 мл розчину солі барію та 0,5 мл розчину хромату калію. Випадає жовтий кристалічний осад хромату барію:
ВаCl2 + K2CrO4 = BaCrO4 + 2KCl
Ba2+ + CrO42- = BaCrO4
Отриманий осад розділити на дві частини і перевірити його роз-
чинність в соляній та оцтовій кислоті. У соляній кислоті осад розчиняється за рівнянням
2 BaCrO4 + 2HCl = BaCl2 +BaCr2O7 + H2O
2 BaCrO4 + 2H+ = 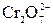 + H2O
+ H2O
Реакція на йон Sr2+ з сірчаною кислотою H2SO4
До 1 мл розчину солі стронцію прилити 0,5 мл розчину сірчаної кис-
лоти, якщо осад відразу не випадає, то дати постояти.
SrCl2 + H2SO4 = SrSO4 + 2HCl
Sr2+ + 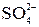 = SrSO4
= SrSO4
Аналітична реакція на йон Cr2+
У пробірку налити 1–2 мл розчину солі Cr2(SO4)3, долити 3–5 мл розчину NaOH та добавити 3–4 краплі розчину H2O2. Нагріти до появи жовтого забарвлення 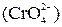 . Написати рівняння відповідних реакцій.
. Написати рівняння відповідних реакцій.
Аналітична реакція на йон Mn2+
У пробірку налити 1–2 краплі дуже розведеного розчину MnSO4, 1–2 краплі AgNO3 (каталізатор), 1 мл розчину NaOH з с(NaOH) = 2 моль/л та
1 мл розчину Na2S2O8. Підігріти. Розчин забарвлюється у характерний червоно-фіолетовий колір  . Написати рівняння реакцій. Чи мож-
. Написати рівняння реакцій. Чи мож-
ливе використання цієї реакції для визначення йонів Ag+?
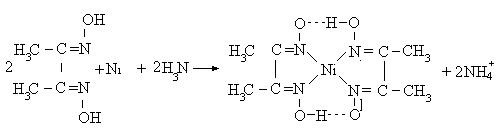
Аналітичні реакції на йон Ni2+ з диметилгліоксимом
(реакція Л.А. Чугаєва)
У пробірку налити краплю розчину солі нітрату нікелю (ІІ), додати
3–6 крапель водного розчину аміаку та 2–3 краплі спиртового розчину диметилгліоксимату. Спостерігають випадання яскраво-червоного осаду диметилгліоксимату нікелю (внутрішньокомплексна сполука). Реакція ду-
же чутлива! Використовується для виявлення йонів Ni2+ у стічних водах.
Аналітичні реакції на йон Со2+ з нітратом калію
2–3 краплі розчину нітрату кобальту (ІІ) налити у пробірку, додати декілька крапель розчину СН3СООН до рН=3 (проба універсальним індикатором) та 1–2 краплі розчину нітрату калію. Випадає жовтий кристалічний осад K3[Co(NO2)6].
Co(NO3)2 + 7KNO2 + 2СН3СООН = K3[Co(NO2)6]↓ + NO +
+ 2KNO3 + 2СН3СООK + H2O
Co+2 +  + 3K+ + 2СН3СООН = K3[Co(NO2)6]↓ + NO + 2СН3СОО- + H2O
+ 3K+ + 2СН3СООН = K3[Co(NO2)6]↓ + NO + 2СН3СОО- + H2O
Реакція на йон Hg2+ із SnCl2
У пробірку до 0,5 мл розчину хлориду меркурію (ІІ) (сулеми) додати по краплям розчин SnCl2. Утворюється білий осад каломелю (Hg2Cl2), який поступово чорніє.
а) 2HgCl2 + SnCl2 = Hg2Cl2↓ + SnCl4
2HgCl2 + Sn2+ = Hg2Cl2↓+ Sn4+ + 2Cl–
б) Hg2Cl2 + SnCl2 = 2Hg + SnCl4
Hg2Cl2 + Sn2+ = 2Hg + Sn4+ + 2Cl–
КОНТРОЛЬНІ ПИТАННЯ ДО КОЛОКВІУМІВ
ІII. АГРЕГАТНИЙ СТАН РЕЧОВИН
Робота: III. 1.
Визначення маси моля речовини вимірюванням її об’єму в газо-подібному стані.
Робота: III. 2.
Визначення в’язкості системи етиловий спирт – вода.
Ідеальний газ, умови його існування. Основні газові закони і умови їх застосування. Рівняння стану ідеального газу. Практичне застосування рівняння Менделєєва–Клапейрона. Реальні гази та умови їх існування. Рівняння стану реальних газів. Методика роботи і оформлення дослідних даних.
Загальна характеристика рідкого стану. В’язкість і текучість рідини. Одиниці вимірювання в’язкості. Основні рівняння гідродинаміки потоку Ньютона і Пуазейля, умови їх застосування. Причини відхилення від ламі-нарного потоку. Методи визначення в’язкості і фактори, що впливають на в’язкість. В’язкість розчинів високомолекулярних речовин. Методика робо-
ти і оформлення дослідних даних.
ІV. ХІМІЧНА ТЕРМОДИНАМІКА ТА БІОЕНЕРГЕТИКА
Робота: IV. 1.
Визначення теплоти горіння газів за допомогою калориметра Юнкерса.
Робота: IV. 2.
Визначення теплоти розчинення і теплоти гідратації солі.
Основні поняття і термінологія. Перший закон термодинаміки, його математичний вираз. Застосування першого закону термодинаміки до біологічних систем. Термохімія. Закон Гесса і висновки з нього. Стандарт-
ні теплоти (ентальпії) утворення, нейтралізації, згорання, розчинення. Термохімічні розрахунки. Методика виконання роботи та оформлення результатів.
V. ПОВЕРХНЕВІ ЯВИЩА (ПОВЕРХНЕВА ЕНЕРГІЯ, ПОВЕРХНЕВИЙ НАТЯГ ТА АДСОРБЦІЯ
НА МЕЖІ РОЗДІЛУ ФАЗ)
Робота: V. 1.
Визначення поверхневого натягу розчинів методом відліку кра-
пель (сталагмометричним методом)
Робота: V. 2.
Визначення площі та довжини молекули поверхнево-активної речовини
Робота: V. 3.
Адсорбція оцтової кислоти на активованому вугіллі
Робота: V. 4.
Дослідження адсорбції забарвлених речовин із розчинів
Робота: V. 5.
Дослідження адсорбції ізоамілового спирту із розчину за допомогою активованого вугілля
Робота: V. 6.
Визначення повної обмінної ємності (оє) катіоніту
Робота: V. 7.
Визначення вмісту лікарської речовини (глюконату кальцію) в розчині методом йонообмінної адсорбції
Робота: V. 8.
Обезсолювання води за допомогою йонітів
Робота: V. 9.
Розділення йонів Fe3+, Date: 2015-09-24; view: 974; Нарушение авторских прав